hemorragia subaracnoidea espontánea en la emergencia. error
Transcripción
hemorragia subaracnoidea espontánea en la emergencia. error
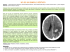
1 HEMORRAGIA SUBARACNOIDEA ESPONTÁNEA EN LA EMERGENCIA. ERROR DIAGNÓSTICO Prof. Agdo. Dr. Carlos Aboal Cátedra de Neurocirugía, Instituto de Neurología Hospital de Clínicas, Facultad de Medicina Montevideo, Uruguay Resumen La Hemorragia Subaracnoidea es, por su elevada morbimortalidad y sus devastadoras consecuencias, una verdadera emergencia neurológica. Requiere un diagnóstico precoz y un tratamiento adecuado, que permitan un mejor manejo de la patología. El pronóstico y las posibilidades de recuperación dependen, en gran medida, de este diagnóstico oportuno y certero así como del subsiguiente tratamiento. Se analizan los errores diagnósticos y se dan pautas para evitarlos. Palabras clave: Error diagnóstico. Hemorragia Subaracnoidea Summary Subarachnoid hemorrhage is a real neurological emergency due to its high morbidity and mortality rates as well as its devastating consequences. An early diagnosis and an adequate treatment are required to achieve a better management of the disease. The prognosis and outcome depend to a great extent on a timely and accurate diagnosis along with the subsequent treatment. Diagnosis errors are reviewed and guidelines to avoid it are provided. Keywords: Diagnostic error. Subarachnoid Hemorrhage. 2 1. INTRODUCCIÓN La Hemorragia Subaracnoidea (HSA) es, por su elevada morbimortalidad y sus devastadoras consecuencias, una verdadera emergencia neurológica. Requiere un diagnóstico precoz y un tratamiento adecuado, que permitan un mejor manejo de la patología, reduciendo el riesgo de complicaciones secundarias e injuria neurológica adicional. El pronóstico y las posibilidades de recuperación dependen, en gran medida, de este diagnóstico correcto y oportuno así como del subsiguiente tratamiento. En las últimas décadas, ha habido grandes avances en las técnicas y procedimientos neuroquirúrgicos, en el instrumental y equipamiento, y en el cuidado y manejo de los pacientes críticos, todo lo cual debería reflejarse en un significativo impacto sobre la morbimortalidad 1. No obstante, existe un factor que conspira contra esto: el importante número de errores diagnósticos detectados en la primera consulta, la que en la mayor parte de los casos se realiza en los Servicios de Emergencia. 2. ERROR DIAGNÓSTICO Mayer et al determinan que se produjo un error diagnóstico (ED) cuando en la evaluación médica inicial no se consideró la posibilidad de un aneurisma subaracnoideo o si el diagnóstico de aneurisma fue realizado más de 24 horas después de que el paciente acudiera en busca de atención médica con síntomas de aneurisma subaracnoideo2. Por su parte, Vermeulen y Schull toman como ED una consulta de un paciente en Emergencia relacionada con una HSA (según definición y parámetros establecidos) en las dos semanas previas a su ingreso a un centro hospitalario3. Se desconoce con certeza el porcentaje de pacientes con aneurismas cerebrales sintomáticos que son diagnosticados erróneamente cuando consultan por primera vez2. Según diferentes estudios el porcentaje de diagnóstico erróneo o tardío varía entre el 12% y el 51%. Este amplio rango refleja la diversidad de métodos de estudio y definiciones utilizados en las distintas investigaciones3. La demora en realizar un diagnóstico correcto deriva, entre otras cosas, en un mayor riesgo de resangrado y mortalidad3. 3. HSA a. Concepto y etiología La HSA es una enfermedad cerebrovascular (ECV). La ECV es definida por la OMS “como un síndrome clínico de déficit cerebral focal (o global, como en el caso de la hemorragia subaracnoidea), de inicio rápido, que dura más de 24 horas (a menos que se interrumpa a causa de cirugía o muerte) sin ninguna causa evidente distinta 3 a la vascular.” En los países desarrollados, aproximadamente 5 a 10% de los casos de ECV corresponden a una hemorragia subaracnoidea4. La HSA se define como la efracción sanguínea en el espacio subaracnoideo, por el que normalmente trascurren el líquido céfalo-raquídeo (LCR) y los vasos sanguíneos. La mayoría de las HSA se produce por traumatismo encéfalo-craneano, mientras que el 80% de las de origen no traumático o espontáneas resulta de la ruptura de aneurismas, por lo general saculares, aunque aun no se conocen a fondo las causas por la que dicha ruptura se produce. El 20% restante es consecuencia de malformaciones arteriovenosas (MAV) y hemorragia intracraniana (HIC) extendida al espacio subaracnoideo. Las principales causas y factores de riesgo son tres: el alcoholismo, el tabaquismo y la hipertensión arterial, las que pertenecen al grupo de factores de riesgo modificables. Los restantes, no modificables, son la enfermedad poliquística de riñón, los antecedentes personales y/o familiares de HSA; y en menor medida, el Síndrome de Ehlers-Danlos tipo IV y la neurofibromatosis tipo I. Posiblemente también coadyuven el consumo de cocaína y el uso de anticonceptivos orales. b. Epidemiología En lo que respecta a la epidemiología, existen variaciones sustanciales en las cifras de los diversos estudios sobre el tema. En términos generales, se considera que el 10 a 15% de los pacientes fallece inmediatamente después de la ruptura, sin llegar a un centro hospitalario; otro 10% fallece durante la primera semana y un 25% adicional entre la segunda y la cuarta. De aquellos que sobreviven, menos del 50% volverá a llevar una vida normal debido a secuelas irreversibles y discapacitantes 5, 6. Su incidencia es de 10 a 20 casos cada 100.000 habitantes por año. Sin embargo, hay estudios que sostienen que la incidencia es ligeramente inferior. Manno1 señala que la misma oscila entre 6 y 16 casos cada 100.000 habitantes, dependiendo de la población estudiada. En Estados Unidos, esto implica alrededor de 25.000 a 30.000 pacientes por año, cifra que ha permanecido constante en las últimas décadas. Por su parte, de Rooij et al, en el estudio más amplio y reciente sobre el tema7, hablan de una incidencia del 22,7 cada 100.000 habitantes en Japón, 19,7 en Finlandia, 4,2 en América del Sur y Central y 9,1 en las demás regiones. Este trabajo incluye un estudio poblacional en Iquique (Chile), con una incidencia de 3,8. Cabe la salvedad que se trata de un trabajo realizado en una población muy pequeña, por lo que habría que realizar nuevos estudios para poder sostener esta cifra. Generalmente, se produce en personas de entre 20 y 60 años de edad, presentando un pico en la sexta década de la vida (55-60 años). 4 Presenta una frecuencia mayor en mujeres que en hombres (2:1)5 (3:1)1 especialmente en la post menopausia6. Rooij et al7 señalan una incidencia mayor en mujeres de la franja etaria comprendida entre 55 y 85 años. Algunas investigaciones sugieren una incidencia creciente en pacientes añosos y decreciente en hombres. Es más común entre la población de raza negra y de origen hispánico que entre los blancos6,8,9. c. Síntomas y signos Habitualmente, un paciente con HSA puede presentar los siguientes síntomas y signos: SÍNTOMAS Cefalea brusca y severa SIGNOS Nauseas y vómitos Mareos Fatiga Diplopia Fotofobia Convulsiones Dolor en cuello y espalda Rigidez de nuca Kerning y Brudsinky Anomalías o alteraciones en el campo visual Hemorragias subhialoideas Parálisis oculomotoras Hemiparesias Afasia - paraparesia Hipertensión arterial Confusión, agitación, coma Existen dos conceptos a destacar en lo que refiere a los síntomas de la HSA, importantes en lo relativo al ED. c1) Síntomas de alerta El concepto de “síntomas de alerta” ha formado parte de la historia natural de la HSA de origen aneurismático desde que la misma fuera descrita por primera vez2. A lo largo del tiempo se han utilizado diversos términos para describir los síntomas y signos premonitorios; por ej.: “sentinel bleed” (sangrado centinela), “sentinel headache” (cefalea centinela) o “warning headache” (cefalea de alerta) “minor leak” (goteo), y “warning leak” (sangrado de alerta), término este último atribuido a Gillingham2. 5 Diversas investigaciones informan que dichos síntomas y signos preceden a una HSA en un rango del 5% al 70% de los casos, según las series estudiadas, con un promedio de alrededor del 40%2. Aproximadamente 50% de los pacientes afectados busca atención médica antes de una HSA importante y entre un 16% y 60% de los mismos son mal diagnosticados2. Según el estudio de la OMS, “en los escenarios de medicina general y salas de emergencia hasta el 20% de los pacientes con sospecha de enfermedad cerebrovascular pueden ser mal diagnosticados”4. Si los síntomas y signos de alerta fueran debidamente reconocidos, se podría proceder al tratamiento del aneurisma, evitando las complicaciones tempranas, una hemorragia mayor y la elevada morbimortalidad asociada2. c2) Red flags El segundo concepto es el de ”red flags” (o banderas rojas): se trata de aquellos signos y/o síntomas que pueden indicar que la cefalea tiene una causa grave. Se ha comprobado que la mayoría de los pacientes con una cefalea causada por una patología orgánica o vascular presentan características clínicas que deberían ser consideradas como “red flags”10. La identificación de las mismas debería convertirse en una herramienta que permita seleccionar aquellos pacientes que deben ser sometidos a estudios adicionales para evitar errores y demoras en el diagnóstico y tratamiento10. Entre las “red flags” identificadas podemos citar: RED FLAGS 1. inicio de una cefalea nueva o diferente 2. náuseas o vómitos 3. un dolor de cabeza tipo estallido (“el peor dolor de cabeza de mi vida”) 4. cambios visuales o neurológicos progresivos 5. parálisis 6. debilidad, ataxia o pérdida de coordinación 7. somnolencia, confusión, problemas de memoria o pérdida de conciencia 8. inicio de cefalea después de los 50 años. 9. edema papilar 10. rigidez de nuca 11. inicio de cefalea por ejercicio, actividad sexual o tos 12. enfermedad sistémica 13. entumecimiento 14. asimetría de la respuesta pupilar 15. pérdida sensitiva En ciertos casos, la ocurrencia de uno solo de estos factores se considera lo suficientemente importante como para ameritar nuevos estudios (inicio de un cefalea diferente, la peor de las cefaleas experimentadas o el inicio de una cefalea por ejercicio, actividad sexual o tos). 6 En otros pacientes se considera que una combinación de tres o más “red flags” relevantes (por ej. hemorragia en fondo de ojo, más somnolencia, confusión, trastornos de la memoria o pérdida de conciencia sumado a parálisis) indican que son pacientes que deberían ser derivados de inmediato para continuar con los estudios9. d. Diagnóstico El diagnóstico de la HSA constituye un desafío ya que su presentación inicial frecuentemente se limita a síntomas comunes y signos sutiles: la cefalea suele ser, a menudo, el síntoma predominante y única manifestación de la misma2. Por otra parte, la cefalea de diferentes etiologías, la mayoría benignas (cefaleas primarias, por ej. migraña y cefalea tensional), suele ser una de las causas más frecuentes de consulta en la Emergencia2. La importancia de un diagnóstico correcto y oportuno radica en la posibilidad de instaurar el tratamiento adecuado y prevenir las complicaciones tempranas, principalmente el resangrado (que presentan un mayor riesgo en las primeras 24 horas y de un 15-22% en los 14 días siguientes) y el vasoespasmo (que se produce en un 30% de los casos, siendo característico entre el tercer y quinto día, con un pico entre los días 5 y 14)5. Edlow, Malek y Ogilvy refieren que 2% de todos los pacientes que consultan en Emergencia presentan una cefalea y al 2% de estos se les diagnostica una patología grave6. Las primeras acciones del médico son simples y de rutina: evaluar el paciente, hacer el diagnóstico, aliviar la sintomatología, estudiarlo y tratarlo adecuadamente. Una buena historia clínica y un adecuado examen neurológico son fundamentales en esta etapa. También es esencial un diagnóstico diferencial que permita distinguir entre las múltiples causas de cefaleas primarias y secundarias. Se define como cefalea por HSA aquella de origen brusco, tipo estallido, definida como el peor dolor de cabeza que el paciente ha experimentado en su vida, que alcanza su pico en cuestión de segundos, aunque a veces puede llegar a minutos, y dura al menos una hora10. Resulta prioritario identificar a aquellos pacientes que presentan una cefalea de inicio abrupto y repentino. En estos casos es mucho más peligroso pasar por alto el origen de la cefalea que realizar un sobrediagnóstico, especialmente en aquellos pacientes que han sobrevivido los primeros minutos. 7 La presentación típica de una HSA de origen aneurismático es la instauración paroxística de una cefalea severa y difusa, acompañada por vómitos, nauseas, rigidez de nuca y, a veces, un período transitorio de pérdida de conciencia1. En estos casos el diagnóstico es muy claro y fácil de realizar. Sin embargo, existen presentaciones atípicas que pueden llevar a errores diagnósticos. Se trata de aquellos pacientes que presentan cefaleas más leves y un examen neurológico normal. Puede darse una cefalea sin los demás síntomas e incluso una cefalea que no cumple con las características definidas. La HSA puede confundirse en un primer diagnóstico con cefaleas tipo migraña y tensional, sinusitis, síndrome viral, crisis hipertensiva, meningismo y dolor cervical. El error diagnóstico alcanza el 25%1 y tiene importantes consecuencias clínicas, ya que los pacientes mal diagnosticados tienen peor pronóstico. En suma: Una cefalea puede darse junto con otros síntomas tales como náuseas, vómitos, rigidez de nuca, pérdida de conocimiento o déficit neurológico focal, que apoyan el diagnóstico de HSA, pero no son suficientes para distinguirla de síndromes más benignos. Asimismo, la ausencia de estos síntomas no permite descartar una HSA, ya que hay un porcentaje de casos en que solo se inicia con cefalea. Para evaluar el estado clínico del paciente, en el momento de realizar el diagnóstico se utilizan principalmente dos escalas: la de Hunt & Hesse y la de la World Federation of Neurosusrgeons (WFNS). ESALA DE HUNT y HESS GRADO 0: Aneurisma intacto GRADO 1: Asintomático o mínima cefalea. Rigidez de nuca ligera. GRADO 1A: Sin reacción meníngea o cerebral pero con déficit neurológico establecido. GRADO 2: Cefalea moderada o severa. Rigidez de nuca. Sin déficits neurológicos severos a excepción e afectación de pares craneales. GRADO 3: Somnolencia, confusión o déficits focales leves. GRADO 4: Estupor. Hemiparesia moderada o severa. Alteraciones vegetativas y posiblemente rigidez de descerebración precoz. GRADO 5: Coma profundo. Rigidez de descerebración. Apariencia moribunda. ESCALA WFNS (World Federation of Neurological Surgeons) PARÁMETROS RESULTADO GLASGOW DÉFICIT MOTOR GRADO WFNS 15 Ausente I 14-13 Ausente II 14-13 Presente III 12.7 - IV 6-3 - V 8 Si bien la escala de Hunt y Hess es de uso habitual, tiene la desventaja de ser subjetiva y técnico-dependiente en su interpretación. La elaborada por la WFNS, en cambio, se basa en el Glasgow Coma Scale (GCS) y la presencia o ausencia de déficits motores6. ESCALA GLASGOW APERTURA OCULAR 1. Nunca 2. Al dolor 3. Al estímulo verbal 4. Espontánea RESPUESTA VERBAL 1. Nula 2. Sonidos incomprensibles 3. Palabras inadecuadas 4. Desorientado 5. Orientado RESPUESTA MOTORA 1. Nula 2. En extensión 3. Flexión Anormal 4. Retirada en flexión 5. Localiza el Dolor 6. Obedece órdenes ESCALAS CLÍNICAS COMPARADAS HUNT-HESS GRADO I GRADO II GRADO III GRADO IV GRADO IV Asintomático o cefalea y rigidez de nuca leves Cefalea y rigidez de nuca moderada o grave. Par craneal Confusión o letargia; puede haber leve déficit focal Estupor, moderada o severa hemiparesia Coma profundo, descerebración, apariencia moribunda WFNS GCS 15 GCS 13-14 GCS 13-14 con déficit focal CGS 7-13 +/- déficit focal GCS 3-6 Si la historia clínica y el examen neurológico son normales y no hay “red flags” se debe tratar al paciente y darle el alta. Si por el contrario, se encuentran “red flags”, se debe indicar el estudio por excelencia: la tomografía computada (TC) que actualmente tiene una exactitud diagnóstica de prácticamente el 100% en las 12 primeras horas. Toda vez que la TC sea negativa, equívoca o técnicamente inadecuada, pero persistan las sospechas de HSA, se debe proceder a una punción lumbar (PL), (en ausencia de proceso de efecto de masa). La presencia de xantocromía en el líquido céfalo-raquídeo (LCR) centrifugado confirma una HSA oculta. El estudio siguiente es un estudio angiográfico, de ser posible angio-TC, o en su defecto angiografía 4 vasos, para confirmar aneurisma. La angio-TC es un estudio rápido, realizado mediante un procedimiento mínimamente invasivo. Es muy confiable para el diagnóstico de aneurismas intracraneanos y puede ser realizado en el mismo momento del diagnóstico de HSA, procediéndose a una cirugía de urgencia. 9 4. Principales causas del ED Existen tres causas principales, recurrentes y evitables, por las que se produce el ED: 1) el no considerar que se puede tratar de una HSA 2) la no realización o incorrecta interpretación de la TC. Kowalski et al concluyen que la no realización de una TC es el error más común11. 3) la no realización o incorrecta interpretación de la punción lumbar (PL). Otros factores que pueden llevar a un diagnóstico erróneo son la agudeza del paciente, la capacitación y experiencia del médico que lo atiende y la disponibilidad de los recursos necesarios para establecer un diagnóstico3. Las diferencias metodológicas de los diversos estudios sobre el tema no permiten llegar a conclusiones definitivas acerca de otras causas del ED, tal como diferentes protocolos diagnósticos6. 10 Algoritmo HEMORRAGIA SUBARACNOIDEA ESPONTÁNEA TC DE CRÁNEO Positiva Negativa, dudosa y/o tardía Angiotomografía Punción lumbar Positiva Negativa Necesidad de cirugía de urgencia o emergencia para evacuar procesos expansivos y “clipar” el aneurisma Positiva Arteriografía encefálica Positiva Reconsiderar diagnóstico Negativa Con vasoespasmo HSA G I o II con aneurisma accesible Cirugía precoz HSA G IV, IIIo II con aneurismas complejos Cirugía en diferido Terapia endovascular Negativa Sin vasoespasmo Segunda arteriografía Positiva Negativa Alta RM y reconsiderar diagnóstico 11 CONCLUSIONES • A pesar de los avances en materia de tratamiento de la HSA de origen aneurismático, la morbimortalidad de esta enfermedad sigue siendo elevada. La mortalidad está en el entorno del 50% y 20 a 30% de los sobrevivientes sufren déficits neurológicos focales que afectan significativamente su calidad de vida1. • Todos los integrantes del equipo médico de guardia en un servicio de Emergencia (emergencista, neurocirujano, neurólogo, etc.) deben estar preparados y alertas para el diagnóstico y la estabilización inicial del paciente con HSA. • La capacitación es factor clave para mejorar el reconocimiento de la patología. • 25% de los pacientes ingresados tuvo una hemorragia previa no diagnosticada. Por ello, jamás se debe descartar la posibilidad de una HSA en la Emergencia, cuando el paciente consulta por una cefalea muy intensa y de instauración brusca. • Para reducir la mortalidad se requiere una mejor respuesta de los servicios de Emergencia. • El ED de la HSA es una importante causa de demandas judiciales a nivel mundial, y está comenzando a serlo en nuestro país. 12 BIBLIOGRAFÍA 1. Manno EM. Subarachnoid hemorrhage.Neurol Clin. 2004; 22(2): 347-66 2. Mayer PL et al. Misdiagnosis of Symptomatic Aneurysm. Stroke. 1996;27:1558-1563. Cerebral 3. Vermeulen MJ, Schull MJ. Missed diagnosis of Subarachnoid Hemorrhage in the Emergency Department. Stroke. 2007; 38:1216-1221. 4. Organización Mundial de la Salud. Trastornos neurológicos: desafíos para la salud pública. OMS, 2006. 5. Berbeo Calderón ME, Alvernia Silva JE, Burgos R, Bustamente Zuleta E, Mejía JA, Osorio Fonseca E. Protocolo para el diagnóstico y el tratamiento de la hemorragia subaracnoidea espontánea. Accesado en www.dep19.san.gva.es 6. Edlow JA, Malek AM, Ogilvy CS. Aneurysmal Subarachnoid Hemorrhage: Update for Emergency. J Emerg Med. 2008; 34(3):237-251. 7. De Rooij NK, Linn FHH, van der Plas JA, A lgra A, Rinkel GJE. Incidence of subarachnoid hermorrhage: a systematic review with emphasis on región, age, gender and time trends. J Neurol Neurosurg Psychiatry 2007;78:1365-1372. 8. Eden SV et al. Gender ethnic differences in subarachnoid hemorrhage. Neurology 2008;71:731-735 9. Bruno A, Qualls C. Risk factors for intracerebral and subarachnoid hemorrhage among Hispanics and non-hispanic withes in a New Mexico Community. Neuroepidemiology 2000;19:227-232. 10. Sobri M, Lamont AC, Alias NA, Win MN. Red flags in patients presenting with headache: clinical indications for neuroimaging. The British Journal of Radiology 2003;76:532-535. 11. Davenport R. Acute headache in the Emergency Department. J. Neurol. Neurosurg. Psychiatry 2002;72:33-37. 12. Kowalski RG, Claassen J, Kreiter KT et al. Initial misdiagnosis and outcome after Subaracnoid hemorrhage. JAMA. 2004; 291:866-869