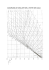Problemas de balances de energía
Transcripción
Problemas de balances de energía
PROBLEMAS DE BALANCES DE ENERGÍA José Abril Requena 2013 © 2013 José Abril Requena INDICE Un poco de teoría ........................................................................................................... 3 Problemas resueltos .....................................................................................................10 Problema 1 ....................................................................................................10 Problema 2 ....................................................................................................11 Problema 3 ....................................................................................................11 Problema 4 ....................................................................................................12 Problema 5 ....................................................................................................13 Problemas sin resolver .................................................................................................14 Problema 6 ....................................................................................................14 Problema 7 ....................................................................................................14 Problema 8 ....................................................................................................14 Problema 9 ....................................................................................................14 Problema 10 ..................................................................................................14 Problema 11 ..................................................................................................14 Problema 12 ..................................................................................................15 Problema 13 ..................................................................................................15 Problema 14 ..................................................................................................15 Problema 15 ..................................................................................................15 Problema 16 ..................................................................................................16 Problema 17 ..................................................................................................16 Problema 18 ..................................................................................................16 Problema 19 ..................................................................................................16 Problema 20 ..................................................................................................17 Problema 21 ..................................................................................................17 Problema 22 ..................................................................................................18 Problema 23 ..................................................................................................18 Problema 24 ..................................................................................................18 Problema 25 ..................................................................................................19 Anejos .......................................................................................................................21 Anejo I: Propiedades Físicas de los Alimentos..............................................................23 Anejo II: Propiedades termodinámicas del agua en sus estados de saturación ..........25 2 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 3 Un poco de teoría El balance de energía es la expresión matemática del primer principio de la Termodinámica, por lo tanto en cualquier proceso será cierto que el calor tomado coincidirá con el calor cedido. Generalmente el balance se establecerá sobre entalpía específica, que en procesos a presión constante equivale al calor intercambiado. Las unidades del balance serán de energía (kJ): ∑ ∑ o de potencia (kW=kJ/s) cuando intervenga el tiempo ∑ ̇ ∑ ̇ Si en el proceso de intercambio térmico se modifica la temperatura, se estará intercambiando calor sensible, que podrá calcularse con las siguientes ecuaciones según intervenga o no el tiempo: Q(𝑘𝐽) m ∙ ∆ℎ 𝑚 ∙ 𝑐 ∙ ∆𝑡 ̇ (𝑊) 𝑚̇ ∙ ∆ℎ 𝑚̇ ∙ 𝑐 ∙ ∆𝑡 siendo Δh la variación que se produce en la entalpía, que se calculará multiplicando el calor específico del producto considerado por la variación de su temperatura, por lo tanto las unidades de la entalpía específica serán: ∆ℎ 𝑘𝐽 𝑐 ( ) ∙ ∆𝑡( ) 𝑘 ∙ 𝑘𝐽 𝑘 Cuando en el proceso de intercambio se produzca un cambio de estado, se estará intercambiando calor latente, por lo que en este caso se deberán utilizar las ecuaciones siguientes: 4 Problemas Resueltos de Balances de Energía Q(𝐽) ̇ (𝑊) 𝑚 ∙ (ℎ − ℎ ) m ∙ ∆ℎ 𝑚̇ ∙ ∆ℎ 𝑚̇ ∙ (ℎ − ℎ ) 𝑚∙𝜆 𝑚̇ ∙ 𝜆 siendo hv la entalpía del vapor y hl la entalpía del líquido en el cambio de estado. La diferencia entre estas dos entalpías coincidirá con el valor de la entalpía de vaporización o calor latente de vaporización λv (o de condensación cuando el cambio de estado comience en un vapor y concluya en un líquido). La ecuación tendría una forma similar si se tratara de un proceso en el que se produjera la congelación del producto considerado. Es evidente que en este caso se debería utilizar el calor latente de congelación (o fusión en el cambio de estado inverso). De lo anterior se deduce que para poder resolver estos problemas se deberán conocer los calores específicos de los productos que se calientan o enfrían y los calores latentes de los que cambian de estado. En la bibliografía se encuentran tablas en las que se recogen muchos de ellos y ecuaciones con las que pueden calcularse en función de su composición y de su temperatura (ver Anejos I y II). Las ecuaciones generales de los balances de energía serán las siguientes: Ecuación general con masas ∑ ∑ ∑ 𝑚 ∙ ∆ℎ ∑ 𝑚 ∙ ∆ℎ Las unidades del balance serán: 𝑘𝐽 𝑚 (𝑘 ) ∙ ∆ℎ ( ) 𝑘 𝑘𝐽 Ecuación general con caudales: ∑ ̇ ∑ ̇ ∑ 𝑚̇ ∙ ∆ℎ ∑ 𝑚̇ ∙ ∆ℎ 𝑚̇ ( 𝑘 𝑘𝐽 ) ∙ ∆ℎ ( ) 𝑘 𝑘𝑊 José Abril Requena (2013) 5 Cuando en el proceso intervienen dos fluidos que intercambian únicamente energía, como ocurre en un cambiador de calor, el balance puede resolverse con el mismo tipo de ecuación que se utilizó para la resolución de los balances de materia, igualando en este caso la energía que entra a la que sale del proceso: ∑ ̇ ∑ ̇ ∑ 𝑚̇ ∙ ℎ ∑ 𝑚̇ ∙ ℎ En este caso los caudales másicos de los productos que entran y salen se multiplicarán por su entalpía para calcular los calores que se han puesto en juego. La ecuación anterior queda más clara al aplicarla al siguiente ejemplo. Si se considera un proceso térmico que tiene lugar en el cambiador de diagrama de flujo siguiente, se tendrá: ∑ ̇ ∑ 𝑚̇ 𝑚̇ ∙ ℎ ∑ ̇ ∙ℎ ∑ 𝑚̇ 𝑚̇ ∙ ℎ 𝑚̇ ∙ ℎ ∙ℎ 𝑚̇ ∙ ℎ como los caudales másicos de cada producto no varían en el proceso: 𝑚̇ ∙ (ℎ ) −ℎ 𝑚̇ ∙ ∆ℎ 𝑚̇ ∙ (ℎ −ℎ ) 𝑚̇ ∙ ∆ℎ Por este camino se ha llegado también a la ecuación inicial, en la que se igualan los calores tomados y cedidos. Como se han sustituido simplemente las masas por los caudales másicos, las unidades del balance serán: 𝑚̇ ( 𝑘 𝑘𝐽 ) ∙ ∆ℎ ( ) 𝑘 𝑘𝑊 6 Problemas Resueltos de Balances de Energía Cómo resolver un balance de energía En primer lugar se deberá determinar qué tipo de calor se intercambia y si se trata de un proceso por cargas o en continuo para elegir las unidades adecuadas para el cálculo. Balance de energía en un proceso por cargas con intercambio de calor sensible Un ejemplo de este tipo sería la mezcla dos productos a diferentes temperaturas. La energía que ceda el producto que se encuentra a mayor temperatura en su enfriamiento será tomada por el que se encuentra a menor temperatura para calentarse, salvo la que corresponda a las pérdidas, por lo que la ecuación del balance será: 𝑚 ∙ ∆ℎ 𝑚 ∙𝑐 𝑚 ∙𝑐 ∙ (𝑡 ∙ ∆𝑡 𝑡 ) 𝑚 ∙ ∆ℎ 𝑚 ∙𝑐 ∙ ∆𝑡 𝑚 ∙𝑐 ∙ (𝑡 − 𝑡 ) Como se observa, en el ejemplo el producto 1 se enfría y el 2 se calienta. En la última ecuación aparecen ocho variables, por lo que para poder resolverla se deberán conocer siete o disponer de otras ecuaciones que las definan. Balance de energía en un proceso en continuo con intercambio de calor sensible En este caso un determinado caudal másico de un producto intercambia calor con el caudal másico de otro producto, considerándose también las pérdidas del proceso. A su paso por el cambiador se modificarán las temperaturas de los dos productos, por lo que se habrá intercambiado calor sensible de acuerdo con la siguiente ecuación: José Abril Requena (2013) ̇ ̇ 𝑚̇ ∙ ∆ℎ 𝑚̇ ∙ 𝑐 𝑚̇ ∙ 𝑐 ∙ (𝑡 −𝑡 ̇ ̇ 𝑚̇ ∙ ∆ℎ ∙ ∆𝑡 ) 7 𝑚̇ ∙ 𝑐 ∙ ∆𝑡 𝑚̇ ∙ 𝑐 ∙ (𝑡 ̇ −𝑡 ) ̇ Como en el caso anterior, el producto 1 se enfría mientras que el 2 se calienta. Se ha incrementado el número de variables en la ecuación final, ahora aparecen nueve. Balance de energía en un proceso por cargas con intercambio de calor latente Sería el caso de una masa de líquido, que se encuentra a una determinada temperatura, y que se vaporiza totalmente cuando se le aplica el calor adecuado. El líquido habrá tomado calor latente y el balance se resolverá con la siguiente ecuación (en este caso no se han considerado pérdidas): 𝑚 ∙ ∆ℎ 𝑚 ∙ (ℎ − ℎ ) 𝑚∙𝜆 Todo el calor cedido se ha empleado en vaporizar la masa de líquido a la temperatura a la que se encontraba. Balance de energía en un proceso en continuo con intercambio de calor latente Sería el caso de que en el proceso, uno de los dos fluidos cambiara de estado. En el cambiador de calor se calienta un determinado caudal másico de producto (toma 8 Problemas Resueltos de Balances de Energía calor sensible) gracias a la condensación del correspondiente caudal de vapor de agua (que cede calor latente). El balance se establecerá por medio de la siguiente ecuación: ̇ 𝑚̇ 𝑚̇ ∙ ∆ℎ ∙ (ℎ −ℎ 𝑚̇ ∙𝜆 ̇ ) 𝑚̇ 𝑚̇ ∙ ∆ℎ 𝑚̇ ∙𝑐 ∙𝑐 ∙ ∆𝑡 ∙ (𝑡 −𝑡 ) El valor del calor latente de vaporización del agua a la temperatura a la que se produzca el cambio de estado se encontrará en las tablas de vapor o se calculará con las ecuaciones apropiadas. Utilización de la ecuación general para el balance de energía en procesos en continuo Los balances en cambiadores se pueden resolver utilizando la ecuación general como se hace a continuación: ∑ ̇ ∑ 𝑚̇ ∙ℎ ∑ ̇ ∑ 𝑚̇ ∙ℎ En el caso representado en el diagrama de flujo la entrada estará constituida por el producto frío y el vapor de agua (fluido calefactor), mientras que en la salida se tendrá al producto que se ha calentado y los condensados del vapor consumido. Por lo tanto uno de los fluidos (el producto) ha intercambiado calor sensible y el otro (el vapor de agua) calor latente, lo que se puede describir de esta forma: 𝑚̇ ∙ ℎ 𝑚̇ ∙ ℎ 𝑚̇ ∙ ℎ 𝑚̇ ∙ ℎ como es evidente, el caudal másico del producto que entra no se modifica en el proceso y ocurre lo mismo con el de vapor que es igual al de condensados producidos, por lo tanto: ) 𝑚̇ ∙ (ℎ 𝑚̇ ∙ (ℎ − ℎ −ℎ ) José Abril Requena (2013) 𝑚̇ ∙ 𝜆 𝑚̇ ∙ 𝑐 9 ∙ ∆𝑡 la modificación de entalpía que sufre el vapor en su condensación coincide con su calor latente y la que sufre el producto será el resultado de multiplicar su calor específico y su salto térmico, siempre y cuando se admita que el calor específico se mantiene constante en el intervalo de temperaturas considerado. 10 Problemas Resueltos de Balances de Energía Problemas resueltos Problema nº1 En un recipiente de cobre aislado térmicamente, que pesa 1 kg y que contiene 5 kg de agua a 10ºC, se introduce un calentador eléctrico de 1500 W de potencia. Calcular el tiempo que transcurrirá hasta que el agua se ponga a hervir, suponiendo que no se producen pérdidas de calor contra el exterior. (cp cobre = 0,385 kJ/kg.K; cp agua = 4,18 kJ/kg.K) Solución: Como no se consideran pérdidas, todo el calor cedido por el calentador se empleará en modificar la temperatura del agua y del recipiente. Para resolver el problema de forma más sencilla se supondrá que la transmisión de calor entre el líquido y la superficie del sólido y en la masa del sólido es instantánea, es decir que se ha conseguido un coeficiente de película infinito y que el cobre tiene una conductividad térmica muy alta. (Esta suposición será más cierta que la que se asume en el enunciado de que no se producirán pérdidas contra el exterior) La solución del problema es una simple aplicación del primer principio de la Termodinámica. ̇ 𝑚 ̇ ∙𝑐 ∙ ∆𝑡 𝑚 ∙𝑐 ∙ ∆𝑡 siendo: ∆𝑡 ∆𝑡 Tanto el agua como el cobre toman calor sensible, luego su temperatura se modifica. El agua no toma calor latente porque la experiencia se detiene justo antes de que comience a hervir. ̇ ̇ 𝑘𝑊 (𝑚 ∙𝑐 ( ∙ ( )∙( 𝑚 ∙ ) )∙( ∙𝑐 ) ∙ ∆𝑡 − ) 𝑚 José Abril Requena (2013) 11 Problema nº2 En un recipiente aisladotérmicamente se mezclan 529 kg de un concentrado de tomate, a 85ºC de temperatura, con 350 kg de agua, a 25ºC de temperatura, para iniciar la fabricación de una salsa. ¿Cuál será la temperatura de la mezcla? (cp conc tomate = 2,83 kJ/kg.K; cp agua = 4,18 kJ/kg.K) Solución: El calor cedido por el concentrado de tomate al enfriarse lo tomará el agua, hasta que las temperaturas de los dos líquidos se igualen. En ambos casos se trata de calor sensible, ya que los dos productos cambian de temperatura. No se considerarán pérdidas ya que el recipiente utilizado se encuentra aislado. 𝑚 ∙𝑐 ∙ ∙ ∆𝑡 𝑚 ∙( −𝑡 ) ∙( −𝑡 ) ∙ ∙𝑐 ∙ ∆𝑡 ∙ (𝑡 − ∙ (𝑡 − ) ) ∙𝑡 𝑡 Problema nº3 Se dispone de un autoclave de una jaula en el que se tratan 900 latas de medio kilo de peso neto por carga. El autoclave está construido en acero inoxidable y pesa 1000 kg. La cesta también es de acero inoxidable y su peso es de 100 kg. Los envases tratados son de hojalata y pesan, en vacío, 50 g cada uno. Calcular el caudal de agua que se consumirá en el proceso de enfriamiento del autoclave, desde 120 hasta 40ºC, si el agua llega al cambiador a 20ºC y lo abandona a 25ºC. (cp producto: 4 kJ/kg.K; cp acero inox: 0,5 kJ/kg.K; cp hoja lata: 0,6 kJ/kg.K) Solución: El agua de enfriamiento deberá ser capaz de tomar todo el calor que se debe eliminar del autoclave, por lo tanto: 12 Problemas Resueltos de Balances de Energía (𝑚 ∙ 𝑐 𝑚 ∙𝑐 𝑚 ∙𝑐 ) ∙ ∆𝑡 𝑚 ∙𝑐 ∙ ∆𝑡 Toda la masa que forma el autoclave se enfriará desde la misma temperatura inicial a la misma temperatura final. 𝑚 ∙ 𝑘 𝑚 𝑘 𝑚 ∙ ( 𝑘 ∙ ∙ ∙ )∙( − ) 𝑚 𝑚 ∙ ∙( − ) 𝑘 Problema nº4 Calcular el vapor saturado a 3 bar (absolutos) necesario para calentar 100 kg de tomate triturado desde 25 a 98ºC. (cp tomate trit. : 3,94kJ/kg.K) Solución: Se trata de un proceso en el que el producto (tomate triturado) toma calor sensible para incrementar su temperatura mientras que el vapor de agua se condensa y cede calor latente, por lo tanto el balance se resolverá con la siguiente expresión: 𝑚 ∙𝜆 𝑚 ∙𝑐 ∙ ∆𝑡 El enunciado proporciona todos los datos salvo el calor latente del vapor en las condiciones de proceso, por lo que se deberá buscar en las tablas del agua y vapor de agua: Vapor saturado a 3 bar de presión absoluta: 𝑡 𝜆 𝑚 ∙ ∙ ∙( − ) José Abril Requena (2013) 𝑚 13 𝑘 Problema nº5 Para congelar 10 kg de fresas, que se encontraban a 20ºC, se han consumido 4200 kJ de energía. ¿A qué temperatura se encontrarán al concluir el proceso? (t cong.= -0,8ºC; cp fresas = 3,85 kJ/kg.K; cp fresas cong = 1,97 kJ/kg.K; λcong = 300 kJ/kg) Solución: Se trata de un proceso en el que en primer lugar las fresas se enfrían hasta la temperatura de congelación, a continuación se congelan y para terminar se subenfrían hasta la temperatura final, por lo tanto se intercambiarán calores sensibles y latentes. El cálculo de los calores de enfriamiento y de congelación es inmediato. 𝑚∙𝑐 ∙ ∆𝑡 ∙ − (− ∙( 𝑚∙𝜆 ∙ )) 𝑘𝐽 𝑘𝐽 Ahora se podrá calcular el calor a eliminar en el subenfriamiento. − − − − El calor de subenfriamiento es un calor sensible. 𝑚∙𝑐 ∙ ∆𝑡 ∙ ∙ ∆𝑡 ∆𝑡 𝑡 − − − 𝑘𝐽 14 Problemas Resueltos de Balances de Energía Problemas sin resolver Problema nº6 Calcular cuánto vapor saturado a 125ºC se consumirá para calentar 200 kg de agua desde 25 hasta 95ºC mediante inyección directa. Problema nº7 ¿Cuántos cubitos de hielo, de 25 g a -10ºC de temperatura, serán necesarios para enfriar un vaso de 250 ml de zumo de naranja desde 25 hasta 10ºC? Considerar que durante el proceso se pierden al ambiente 2,5 kJ. (λhielo: 334 kJ/kg; cp hielo: 2,09 kJ/kg.K) Problema nº8 En un cambiador de calor se enfrían 2500 kg/h de leche entera desde 78 hasta 30ºC, utilizando agua como medio de enfriamiento. Determinar el caudal másico de agua que será necesario si en el proceso se calienta desde 10 hasta 20ºC. Problema nº9 Se deben enfriar 5000 l/h de zumo de uva desde 70 hasta 25ºC. Como fluido refrigerante se utiliza agua a 8ºC, que en el proceso se calienta hasta 15ºC. Calcular el caudal másico de agua que deberá emplearse. Problema nº10 En un cambiador de calor de pared rascada se quieren calentar 2000 kg/h de puré de patata desde 15 hasta 50ºC. Para la calefacción se dispone de un caudal de 1500 l/h de agua 95ºC. ¿A qué temperatura se obtendrá el agua del cambiador? (cp puré: 3,75 kJ/kg.K; cp agua 75ºC: 4,2 kJ/kg.K; ρagua 95ºC: 963,6 kg/m3) Problema nº11 Se pretende calentar a 85ºC un caudal másico de leche desnatada de 3000 kg/h. Para este proceso se dispone de un cambiador de calor en el que se intercambian 150 kW. ¿Hasta qué temperatura se deberá precalentar la leche antes de introducirla al cambiador?. José Abril Requena (2013) 15 Problema nº12 Se quieren precalentar 10000 kg/h de un aceite vegetal en un cambiador de calor contra 5000 kg/h de agua. Si la temperatura del agua a su llegada al cambiador es de 95ºC y al dejarlo de 40ºC y la temperatura inicial del aceite es de 15ºC, calcular a que temperatura abandonará el aceite el cambiador. (cp aceite: 2,011kJ/kg.K; cp agua a 60ºC: 4,19 kJ/kg.K) Problema nº13 En un cambiador de calor se calientan 4000 l/h de zumo de uva desde 5 hasta 70ºC. Para el calentamiento se utiliza vapor saturado a 5 bar absolutos de presión. ¿Qué caudal másico de vapor se consumirá si en el intercambio solo cede su calor latente. (cp zumo: 3,661 kJ/kg.K; ρzumo: 1114,2 kg/m3) Problema nº14 En un cambiador de calor se calientan 1000 kg/h de leche entera desde 45 hasta 72ºC. Como medio de calefacción se emplea agua, que se introduce al cambiador a 90ºC y lo deja a 75ºC. Calcular el caudal másico de agua necesario sabiendo que existen unas pérdidas de calor al ambiente de 1 kW. Problema nº15 Calcular las modificaciones de entalpía que se producen cuando 5 kg de hielo, que se encuentra a -15ºC, se llevan a presión atmosférica hasta vapor saturado a 100ºC de temperatura siguiendo el proceso representado en la gráfica. (cp hielo: 2,05 kJ/kg.K; cp agua: 4,182 kJ/kg.K; λfusión: 333,2 kJ/kg; λvapor 100ºC: 2257,06 kJ/kg.K) 16 Problemas Resueltos de Balances de Energía Problema nº16 Un alimento líquido, con un caudal de 2000 kg/h y a una temperatura de 25ºC, se trata en un cambiador de calor para que su temperatura alcance los 75ºC. Como fluido calefactor se utiliza agua a 95ºC que en el proceso se enfría hasta 80ºC. Calcular el caudal de agua necesario sabiendo que el calor específico del líquido es de 4,0 kJ/kg.K. Problema nº17 Para fabricar una salsa se mezclan en línea dos ingredientes y la mezcla se calienta aplicándole 400 kW. El primer ingrediente llega a la mezcla a 50ºC con un caudal de 2 kg/s, siendo su calor específico de 3,0 kJ/kg.K. El caudal del segundo ingrediente es de 0,6 kg/s, su temperatura de 2ºC y su calor específico de 2,15 kJ/kg.K. Calcular la temperatura a la que se obtendrá la mezcla. Problema nº18 Se mezclan 1 kg/s del alimento A, que se encuentra a 25ºC de temperatura con 0,25 kg/s del alimento B que se encuentra a 85ºC de temperatura. Calcular la temperatura de la mezcla sabiendo que los calores específicos de estos alimentos se ajustan a las ecuaciones siguientes: 𝑐 ∙𝑡 𝑐 ∙𝑡 Problema nº19 Calcular el vapor saturado a 6 bar de presión manométrica que será necesario para calentar 2500 kg/h de zumo de manzana desde 5 a 95ºC. José Abril Requena (2013) 17 Problema nº20 Una fábrica de conservas utiliza un autoclave de agua sobrecalentada, de 6 jaulas de capacidad y completamente aislado, para esterilizar un producto envasado en latas de 1 kg. El producto entra al autoclave después de ser precalentado a 45ºC y en el proceso alcanza una temperatura máxima de 120ºC después de 40 minutos de calentamiento. El proceso finaliza cuando el producto se ha enfriado hasta 40ºC, lo que se consigue con un enfriamiento de 30 minutos. Calcular: a) El caudal másico medio de vapor de agua, a 4 bar manométricos, que será necesario para el calentamiento. b) El caudal másico de agua necesaria para el enfriamiento suponiendo que entra al cambiador a 20ºC y lo abandona a 27ºC. El autoclave está construido en acero inoxidable y pesa 1200 kg. Las jaulas, también de acero inoxidable, pesan en vacío 123 kg y pueden contener 510 latas de 1 kg neto. Para la transferencia de calor cada jaula dispone de 100 litros de agua. Las latas son de hojalata y pesan 50 gr. Al comienzo de la operación el autoclave, las jaulas y el agua se encuentran a 25ºC. (cp hojalata = 0,6 kJ/kg.K; cp producto = 4 kJ/kg.K; cp agua = 4,18 kJ/kg.K; cp acero inox = 0,5 kJ/kg.K) Problema nº21 Un generador de vapor alimenta un cambiador de placas con vapor de agua a 8 bar manométricos. En el intercambio térmico se ceden 750 kW y los condensados se recuperan a 96ºC. 18 Problemas Resueltos de Balances de Energía El generador de vapor quema gasóleo con un PCI de 40000 kJ/kg y en esta combustión se producen 20 kg de humos/kg de combustible. Calcular el caudal másico de gasóleo que se consumirá. (cp humos: 1 kJ/kg.K) Problema nº22 A un sistema de esterilización por inyección directa de vapor llegan 2 l/s de leche entera a 80ºC. Si se quiere que la temperatura de proceso alcance 145ºC y el vapor se inyecta a 4 bar manométricos, calcular el consumo de gasóleo del generador de vapor. (PCI gasóleo: 40000 kJ/kg; Se producen 22 kg de humos/kg combustible; cp humos: 1 kJ/kg.K) Problema nº23 En una instalación frigorífica de doble compresión, con enfriamiento intermedio de los gases por cambiador de calor como la del esquema, circula por el evaporador un caudal másico de R-134a de 0,1 kg/s. Calcular el caudal másico de refrigerante que deberá circular por el cambiador de calor cuando se cumpla el ciclo de la figura. (h1: 390 kJ/kg; h2: 420 kJ/kg; h3: 400 kJ/kg; h6: 228 kJ/kg) Problema nº24 En una instalación frigorífica de doble compresión, con enfriamiento intermedio de los gases por inyección directa de refrigerante como la del esquema, el compresor de baja maneja un caudal másico de R-134a de 0,1 kg/s. Calcular el caudal másico de refrigerante que deberá manejar el compresor de alta cuando se cumpla el ciclo de la figura. (h2: 420 kJ/kg; h3: 400 kJ/kg; h6: 228 kJ/kg) José Abril Requena (2013) 19 Problema nº25 En una instalación frigorífica de doble compresión, por inyección total de refrigerante como la del esquema, el compresor de baja maneja un caudal másico de R134a de 0,1 kg/s. Calcular el caudal másico de refrigerante que deberá manejar el compresor de alta cuando se cumpla el ciclo de la figura. (h2: 420 kJ/kg; h3: 400 kJ/kg; h6: 228 kJ/kg; h7: 200 kJ/kg) 20 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 21 Anejos 22 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 23 Anejo I: Propiedades Físicas de los Alimentos Choi, Y. y Okos, M.R. (1986) “Food Enginnering and Process Applications”. Elsevier Applied Science. London Para el cálculo del calor específico y de la densidad de los alimentos es útil montar una herramienta de cálculo como la que se muestra a continuación. De esta forma al introducir la composición del alimento en las celdas C8 a C13 se obtendrá el calor específico y la densidad a la temperatura de la celda F5. Celda F8 F9 F10 F11 F12 F13 Calor específico (kJ/kg.K) =4,1762-0,000090864*F5+0,0000054731*F5^2 =2,0082+0,0012089*F5-0,0000013129*F5^2 =1,9842+0,0014733*F5-0,0000048008*F5^2 =1,5488+0,0019625*F5-0,0000059399*F5^2 =1,8459+0,0018306*F5-0,0000046509*F5^2 =1,0926+0,0018896*F5-0,0000036817*F5^2 Celda G8 G9 G10 G11 G12 G13 Densidad (kg/m ) =997,18+0,0031439*F5-0,0037574*(F5^2) =1329,9-0,5184*F5 =925,59-0,41757*F5 =1599,1-0,31046*F5 =1311,5-0,36589*F5 =2423,8-0,28063*F5 3 24 Problemas Resueltos de Balances de Energía Celda C15 =SUMA(C8:C14) Resultado E17 E18 =(F8*C8/100)+(F9*C9/100)+(F10*C10/100)+(F11*C11/100)+(F12*C12/100)+(F13*C13/100) =(G8*C8/100)+(G9*C9/100)+(G10*C10/100)+(G11*C11/100)+(G12*C12/100)+(G13*C13/100) La composición de los alimentos de los problemas es la de la siguiente tabla: Leche desnatada Composición alimentos (%) Leche Zumo de Zumo de Tomate entera naranja manzana triturado Zumo de uva 90,5 87,4 87,2 84,9 90,4 Proteínas 3,4 3,5 0,7 0,5 2,3 Grasas 0,1 3,5 0,2 0 0,1 0 Carbohidratos 5 4,9 10,1 13,8 5,5 20 Fibra 0 1 0 0,7 0 1,8 0 0,8 1,2 0,5 0 Agua Cenizas 80 0 0 José Abril Requena (2013) Anejo II: Propiedades termodinámicas del agua en sus estados de líquido y vapor saturados 25 26 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 27 28 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 29 30 Problemas Resueltos de Balances de Energía José Abril Requena (2013) 31