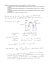PRACTICA 6. Electoquimica. Determinación de magnitudes
Transcripción
PRACTICA 6. Electoquimica. Determinación de magnitudes
Práctica laboratorio: “Determinación de magnitudes termodinámicas de una reacción redox” Steve Jurvetson from Menlo Park, USA Flickr Creative Commons Attribution 2.0 Generic license. http://commons.wikimedia.org/wiki/File:Electrochemistry.jpg Jorge Bañuelos, Luis Lain, Leyre Pérez, Maria Nieves Sánchez Rayo, Alicia Torre, Miren Itziar Urrecha Dpto Química Física PRÁCTICA LABORATORIO: “Determinación de magnitudes termodinámicas para una reacción redox” OBJETIVO: Determinar ∆Sº, ∆Gº eta ∆Hº para una reacción oxidación-reducción . MEDIDA EXPERIMENTAL: Determinación de la fuerza electromotriz de una pila a diferentes temperaturas Zn ZnSO4(aq) K3Fe(CN)6(aq), K4Fe(CN)6(aq)Pt Determinación de magnitudes termodinámicas de una reacción redox FUNDAMENTO PRÁCTICO MATERIALES 2 vaso precipitados de 150 cm3 1 matraz aforado de 100 cm3 1 pipeta graduada de 10 cm3 2 pipetas Pasteur 1 pipeteador Una célula de vidrio en forma de H Electrodo de Pt Electrodo de Zn Potenciómetro Pila patrón Baño termostático Termómetro digital SUBSTANCIAS Sulfato de zinc (s) Ferrocianuro de potasio (s) Ferricianuro de potasio (s) Cloruro potásico (ac. sat.) Ácido nítrico-agua (2:3) Determinación de magnitudes termodinámicas de una reacción redox PROCEDIMIENTO EXPERIMENTAL Preparar disoluciones determinando la molaridad por pesada (exactas) 1.Disolución [ZnSO4] [K3Fe(CN)6] 2.Disolución [K Fe(CN) ] 4 6 A B C D 0,8 1,0 1,3 1,5 0,08 0,08 0,10 0,10 0,13 0,13 0,15 0,15 Limpiar los electrodos de Pt y Zn (emplear ácido nítrico si fuera necesario) Determinación de magnitudes termodinámicas de una reacción redox C u´ Zn ZnSO4 (ac) Disolución 1 Ajustar potenciómetro con pila patrón Medir f.e.m. a diferentes Tª 10-50ºC (cada 5ºC) Pt ´ K3Fe(CN)6 K4Fe(CN)6 Disolución 2 Determinación de magnitudes termodinámicas de una reacción redox ANÁLISIS DE RESULTADOS ZnSO4(aq)Zn semielemento K3Fe(CN)6(aq), K4Fe(CN)6(aq)Pt semielemento Cuál es el ánodo? Cuál es el cátodo? Por qué? Zn ZnSO4(aq) K3Fe(CN)6(aq), K4Fe(CN)6(aq)Pt (-) (+) ánodo cátodo oxidación reducción Determinación de magnitudes termodinámicas de una reacción redox Determinación de ∆Sº En el laboratorio se determinará ε, no εº , pero ∂ε ≈ ∂εº = ∆Sº ∂TP,n ∂T P,n nF i i P constante: P = P(atmosférica) ni constante: la pila está en equilibrio no hay reacción neta ε vs T representar (Excel) ∆S º Pendiente (a 25º C) = nF Determinación de magnitudes termodinámicas de una reacción redox ∆Sº constante Línea recta E vs T 1,76 1,72 1,74 1,70 1,72 1,68 E/V 1,70 E/V y = 0,00284x + 0,78900 R2 = 1,00000 E vs T y = -0,00284x + 2,54300 R2 = 1,00000 1,68 (A) figura: ∆Sº < 0 1,66 1,64 1,66 1,60 1,62 1,60 280,0 (B) figura: ∆Sº > 0 1,62 1,64 290,0 300,0 310,0 320,0 330,0 1,58 280,0 290,0 310,0 320,0 T/K T/K (A) 300,0 (B) Pendiente = ∆ Sº nF 330,0 Determinación de magnitudes termodinámicas de una reacción redox F: Constante de Faraday 96485 C.mol-1 n:2 cátodo: ánodo: (Fe(CN)63- + 1 e- → Fe(CN)64-).2 Zn → Zn2+ + 2e- 2Fe(CN)63- + Zn → 2Fe(CN)64- + Zn2+ Determinación de ∆Gº ∆Gº = -nFεº (se determina a 25,0ºC) εº = εºcátodo - εºánodo (tablas) Determinación de ∆Hº Después de conocer ∆Sº y ∆Gº: ∆Gº = ∆Hº - T∆Sº Determinación de magnitudes termodinámicas de una reacción redox Relación con el Coeficiente de actividad Usando puente salino εJ ≈ 0 eta f.e.e. = εNerst = εorek 2 Fe(CN)63- + Zn → 2 Fe(CN)64- + Zn2+ ε Nerst = εo − RT ln nF a 2 Fe(CN) 4 − 6 a a 2 Fe(CN) 3 − 6 Zn 2+ aZn Zn sólido puro: a Zn = 1 Como, ai = γi.mi ε Nerst = εo − RT ln nF γ Fe(CN ) 4 − 6 γ m 2 Fe(CN) 4 − 6 Fe(CN) 3 − 6 m γ Zn 2+ m 2 Fe(CN) 3 − 6 Zn 2+ Determinación de magnitudes termodinámicas de una reacción redox εNerst = εo − RT ln nF m 2 4 − Fe(CN) 6 m m Zn 2 2+ 3 − Fe(CN) 6 − RT ln nF γ 2 4 − Fe(CN) 6 γ γ Zn 2 2+ 3 − Fe(CN) 6 25,0ºC-tan: ε(de la gráfica), εº(de las tablas), n y m conocidas : Se puede determinar el cociente: γ 2 4 − Fe(CN) 6 γ γ Zn 2+ 2 3 − Fe(CN) 6 Usando la teoría Debye eta Hückel se puede determinar también γ Zn 2 + γ Zn 2+ ≈ γ ± (ZnSO4 )