Criterios para la autorización previa
Transcripción
Criterios para la autorización previa
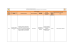
Criterios para la PA Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ACTHAR H.P. ACTHAR Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Uso en pacientes con esclerosis múltiple (EM) como terapia de pulso todos los meses. Exacerbación de la EM, antecedentes de uso de corticoesteroides. Espasmos infantiles indicados por un neurólogo o epileptólogo, o después de consultarlo con uno de estos especialistas. Exacerbación de la EM indicada por un neurólogo o médico especializado en el tratamiento de la EM, o después de consultarlo con uno de estos especialistas. Exacerbación de la EM: 1 mes. Todos los demás diagnósticos: 6 meses Para la exacerbación de la EM, aprobar si el paciente no puede usar una dosis alta de corticoesteroides intravenosos debido a que el acceso intravenoso no es posible o si el paciente ha probado con dosis alta de corticoesteroides administrada de modo intravenoso para una exacerbación aguda de la EM y ha experimentado un efecto adverso grave o limitante. ADCIRCA ADCIRCA Todas las indicaciones médicamente aprobadas no excluidas de la Parte D El paciente requiere terapia con nitrato con regularidad o en forma intermitente. Declaración del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 1 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ALECENSA ALECENSA Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios AMPYRA AMPYRA Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D 12 meses 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 2 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida B VS. D ABRAXANE, ACETYLCYSTEINE, ACYCLOVIR SODIUM, ADRUCIL, ALBUTEROL SULFATE, AMBISOME, AMINOSYN 7%/ELECTROLYTES, AMINOSYN 8.5%/ELECTROLYTE, AMINOSYN II, AMINOSYN II 8.5%/ELECTROL, AMINOSYN M, AMINOSYN-HBC, AMINOSYN-PF, AMINOSYN-PF 7%, AMINOSYN-RF, AMPHOTERICIN B, ARRANON, ARZERRA, ASTAGRAF XL, AVASTIN, AZASAN, AZATHIOPRINE, BICNU, BIVIGAM, BLEOMYCIN SULFATE, BUDESONIDE, BUSULFEX, CARBOPLATIN, CARIMUNE NANOFILTERED, CELLCEPT INTRAVENOUS, CISPLATIN, CLADRIBINE, CLINIMIX 2.75%/DEXTROSE 5, CLINIMIX 4.25%/DEXTROSE 1, CLINIMIX 4.25%/DEXTROSE 2, CLINIMIX 4.25%/DEXTROSE 5, CLINIMIX 5%/DEXTROSE 15%, CLINIMIX 5%/DEXTROSE 20%, CLINIMIX 5%/DEXTROSE 25%, CLINIMIX E 2.75%/DEXTROSE, CLINIMIX E 4.25%/DEXTROSE, CLINIMIX E 5%/DEXTROSE 15, CLINIMIX E 5%/DEXTROSE 20, CLINIMIX E 5%/DEXTROSE 25, CLINISOL SF 15%, CLOLAR, CROMOLYN SODIUM, CYCLOPHOSPHAMIDE, CYCLOSPORINE, CYCLOSPORINE MODIFIED, CYRAMZA, CYTARABINE AQUEOUS, DACARBAZINE, DARZALEX, DAUNORUBICIN HCL, DECITABINE, DEXRAZOXANE, DOXORUBICIN HCL, DRONABINOL, DURAMORPH, ELITEK, EMEND, EMPLICITI, ENGERIX-B, ENVARSUS XR, ERBITUX, ETOPOSIDE, FLEBOGAMMA, FLEBOGAMMA DIF, FLUDARABINE PHOSPHATE, FREAMINE HBC 6.9%, FUSILEV, GAMMAGARD LIQUID, GAMMAGARD S/D IGA LESS TH, GAMMAKED, GAMMAPLEX, GAMUNEX-C, GENGRAF, GRANISETRON HCL, HEPARIN SODIUM, HEPATAMINE, HERCEPTIN, HYPERLYTE-CR, IFOSFAMIDE, INTRALIPID, INTRON A, INTRON A W/DILUENT, IPRATROPIUM BROMIDE, IPRATROPIUM BROMIDE/ALBUT, LEUCOVORIN CALCIUM, LEVALBUTEROL, LEVALBUTEROL HCL, LEVOCARNITINE, LEVOLEUCOVORIN CALCIUM, MESNA, METHADONE HCL, METHOTREXATE, METHOTREXATE SODIUM, MIACALCIN, MITOMYCIN, MITOXANTRONE HCL, MYCOPHENOLATE MOFETIL, MYCOPHENOLIC ACID DR, NEBUPENT, NEPHRAMINE, NULOJIX, NUTRILIPID, OCTAGAM, ONDANSETRON HCL, ONDANSETRON ODT, OXALIPLATIN, PACLITAXEL, PAMIDRONATE DISODIUM, PARICALCITOL, PLENAMINE, PREMASOL, PRIVIGEN, PROCALAMINE, PROLEUKIN, PROSOL, PULMOZYME, RAPAMUNE, RECOMBIVAX HB, SANDIMMUNE, SIMULECT, SIROLIMUS, SOLUMEDROL, TACROLIMUS, TETANUS/DIPHTHERIA TOXOID, THIOTEPA, THYMOGLOBULIN, TOBRAMYCIN, TOPOSAR, TPN ELECTROLYTES, TRAVASOL, TREXALL, TROPHAMINE, UVADEX, VELCADE, VENTAVIS, VINBLASTINE SULFATE, VINCASAR PFS, VINCRISTINE SULFATE, VINORELBINE TARTRATE, ZANOSAR, ZORTRESS N/A H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 3 Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios N/A BOSULIF BOSULIF Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Requiere un panel de la función hepática y un conteo sanguíneo completo (CSC), una prueba y falla con ofimatinib o dasatinib y la documentación de respuesta a los 90 días 12/31/16 CAYSTON CAYSTON Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 4 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios CHORIONIC GONATROPINS CHORIONIC GONADOTROPIN, NOVAREL, PREGNYL W/DILUENT BENZYL Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios CLONAZEPAM CLONAZEPAM, CLONAZEPAM ODT Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida COLONY STIMULATING FACTORS LEUKINE, NEULASTA, NEULASTA ONPRO KIT, NEUPOGEN, ZARXIO Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Declaración de respaldo del diagnóstico de parte del médico y recuento absoluto de neutrófilos (inferior o igual a 1000 células/mm3). Para la prórroga de la autorización previa, se deben proporcionar nuevos análisis de laboratorio (recuento de glóbulos blancos y recuento absoluto de neutrófilos) 3 meses H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 5 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios COTELLIC COTELLIC Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ENBREL ENBREL, ENBREL SURECLICK Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida ESBRIET ESBRIET Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios 12 meses Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Diagnóstico (fibrosis pulmonar idiopática [FPI]) y control adecuados (función hepática/análisis de la función hepática [LFT]) La persona autorizada a dar recetas debe ser un pulmonólogo 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 6 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ESRD THERAPY ARANESP ALBUMIN FREE, EPOGEN, PROCRIT Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Valores de hemoglobina inferiores a 10 g/dl para pacientes que reciben tratamiento de quimioterapia para el cáncer, y valores de hemoglobina de 11 g/dl o menos para otras indicaciones aprobadas por la FDA, además de la declaración de respaldo del diagnóstico de parte del médico 3 meses Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios FARYDAK FARYDAK Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios FENTANYL FENTANYL, FENTANYL CITRATE ORAL TRA Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración del diagnóstico de parte del médico 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 7 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios FLECTOR FLECTOR Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida GILOTRIF GILOTRIF Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios 12/31/16 Declaración de respaldo del diagnóstico de parte del médico en pacientes con EGFR con eliminación del exón 19 o sustitución del exón 21 (L858R) según lo detecte una prueba aprobada por la FDA 12/31/16 GROWTH HORMONE GENOTROPIN, HUMATROPE, NORDITROPIN FLEXPRO, NUTROPIN AQ NUSPIN 10, NUTROPIN AQ NUSPIN 20, NUTROPIN AQ NUSPIN 5, NUTROPIN AQ PEN, OMNITROPE, SAIZEN, SAIZEN CLICK.EASY, SEROSTIM, ZOMACTON Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 8 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios HARVONI HARVONI Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Se debe presentar documentación de hepatitis C crónica, genotipo (confirmada por nivel de ARN de VHC en los últimos 6 meses) y subtipo. Se deben presentar los resultados de laboratorio dentro de las 6 semanas de comenzado el tratamiento: 1) CSC con plaquetas, 2) AST/ALT, 3) bilirrubina total, 4) albúmina sérica, 5) PT/INR, 6) creatinina sérica, y 7) IFG El paciente debe tener 18 años o más La persona autorizada a dar recetas debe ser un gastroenterólogo, hepatólogo o especialista en enfermedades infecciosas 8, 12 o 24 semanas. Consulte la sección Otros criterios para conocer los requisitos de aprobación. 24 semanas: después de un trasplante de hígado, tratamiento con experiencia en cirrosis, 12 semanas: todas las demás indicaciones HEPATITIS C MODERIBA, MODERIBA 1200 DOSE PACK, MODERIBA 800 DOSE PACK, PEGASYS, PEGASYS PROCLICK, RIBASPHERE, RIBASPHERE RIBAPAK, RIBAVIRIN Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico, presentación de títulos de virus antes del tratamiento (VHC ARN) y genotipo. 12/31/2016 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 9 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios HRM ALORA, AMITRIPTYLINE HCL, ASCOMP/CODEINE, BENZTROPINE MESYLATE, BUTALBITAL/ACETAMINOPHEN/, BUTALBITAL/ASPIRIN/CAFFEI, BUTISOL SODIUM, CHLORDIAZEPOXIDE HCL, CHLORDIAZEPOXIDE/AMITRIPT, CLEMASTINE FUMARATE, CLOMIPRAMINE HCL, CYCLOBENZAPRINE HCL, CYPROHEPTADINE HCL, DICYCLOMINE HCL, DIGITEK, DIGOXIN, DISOPYRAMIDE PHOSPHATE, DOXEPIN HCL, ERGOLOID MESYLATES, ESTRADIOL, ESTROPIPATE, GLYBURIDE, GLYBURIDE MICRONIZED, GLYBURIDE/METFORMIN HCL, GUANFACINE ER, IMIPRAMINE HCL, IMIPRAMINE PAMOATE, MEGESTROL ACETATE, MENEST, MEPROBAMATE, METHYLDOPA, METHYLDOPA/HYDROCHLOROTHI, METHYLPHENIDATE HCL ER, PERPHENAZINE/AMITRIPTYLIN, PHENOBARBITAL, PROMETHAZINE HCL, RESERPINE, SECONAL SODIUM, TRIHEXYPHENIDYL HCL, TRIMIPRAMINE MALEATE, ZOLPIDEM TARTRATE, ZOLPIDEM TARTRATE ER Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico, edad y alguno de los siguientes documentos: documentación que respalde la necesidad o el beneficio en comparación con la declaración de riesgo del uso del medicamento en personas mayores de 65 años 12/31/16 Si son menores de 65 años, están eximidas de la restricción H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 10 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios HRM DIAZEPAM DIASTAT ACUDIAL, DIASTAT PEDIATRIC, DIAZEPAM, DIAZEPAM INTENSOL Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico, edad y alguno de los siguientes documentos: documentación que respalde la necesidad o el beneficio en comparación con la declaración de riesgo del uso del medicamento en personas mayores de 65 años 12/31/16 Si son menores de 65 años, están eximidas de la restricción HRM NITROFURANTOIN NITROFURANTOIN MACROCRYST, NITROFURANTOIN MONOHYDRAT Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico, edad y alguno de los siguientes documentos: documentación que respalde la necesidad o el beneficio en comparación con la declaración de riesgo del uso del medicamento en personas mayores de 65 años 90 días Si son menores de 65 años, están eximidas de la restricción H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 11 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios HRM THIORIDAZINE THIORIDAZINE HCL Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico, edad y alguno de los siguientes documentos: documentación que respalde la necesidad o el beneficio en comparación con la declaración de riesgo del uso del medicamento en personas mayores de 65 años 12/31/16 Si son menores de 65 años, están eximidas de la restricción HRM-MEGESTEROL MEGESTROL ACETATE Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Medicamento de alto riesgo. Aprobado automáticamente para beneficiarios de 64 años o menos. Declaración de necesidad médica para usar este medicamento de alto riesgo, Y plan de supervisión de efectos secundarios adversos Y duración/curso anticipado del tratamiento. Para personas de 64 años o menos, la reclamación del medicamento requerido se paga automáticamente. Para personas de 65 años o más, se requiere solicitud de excepción de autorización previa en la que se especifique una indicación médicamente aceptada no excluida de la Parte D. 12 meses H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 12 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios HUMIRA HUMIRA, HUMIRA PEN, HUMIRA PEN-CROHNS DISEASE Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida ICLUSIG ICLUSIG Todas las indicaciones médicamente aprobadas no excluidas de la PARTE D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Aprobado para todas las indicaciones médicamente aprobadas con prueba y falla de otro inhibidor de la tirosina quinasa (ITQ). 12/31/16 IMBRUVICA IMBRUVICA Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 13 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios IRESSA IRESSA Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión JUXTAPID JUXTAPID 30mg, 40mg, 60mg Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. En caso de inicio del tratamiento, disfunción hepática grave o moderada (por ejemplo, índice de Child-Pugh B o C). En caso de renovación, ALT o AST igual o mayor que 5 veces el límite normal máximo (upper limit normal, ULN), o igual o mayor que 3 veces el ULN con signos o síntomas de toxicidad o lesión hepática, aumentos de la bilirrubina mayor que 2 veces el ULN o enfermedad hepática activa. En caso de inicio del tratamiento, 1. el paciente tiene un diagnóstico de hipercolesterolemia familiar homocigótica confirmada mediante alguna de las siguientes situaciones: A. mutaciones documentadas en ambos alelos del receptor LDL, ApoB, PCSK9 o locus de gen de proteína adaptadora de hipercolesterolemia autosómica recesiva (ARH), B. fibroblasto de piel del receptor LDL con una actividad documentada de menos del 20% de lo normal, O C. si se cumplen los siguientes criterios: a) presencia de LDL-C no tratado superior a 500 mg/dl o desconocido Y b) presencia de xantomas cutáneos o de tendón en menores de 10 años O c) ambos padres tienen antecedentes de LDL-C superior a 190 mg/dl; Y 2. antes del inicio del tratamiento con Juxtapid, el paciente está o estaba recibiendo una combinación actual de régimen reductor de lípidos que consta al menos de 2 de las siguientes opciones de tratamiento durante al menos 30 días: para adultos: 200 mg por semana de simvastatin, cholestyramine, colestipol, ezetimibe, gemfibrozil o mipomersen Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios 12 meses Especialista en lípidos, especialista cardiometabólico o endocrinólogo 12 meses H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 14 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios KALYDECO KALYDECO Todos los usos médicamente aceptados no excluidos de la Parte D Declaración de respaldo del diagnóstico de parte del médico. Fibrosis quística, en pacientes con una mutación G551D en el gen CFTR 12/31/16 KEYTRUDA KEYTRUDA Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Ninguno Diagnóstico adecuado, prueba/falla de Yervoy, y si la mutación BRAF V600 es positiva, también se debe probar un inhibidor de BRAF 12/31/16 KINERET KINERET Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 15 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios KORLYM KORLYM Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Embarazo Declaración de respaldo del diagnóstico e información médica relevante de parte del médico 12/31/16 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios LIDODERM LIDOCAINE Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios LONSURF LONSURF Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Declaración de respaldo del diagnóstico de parte del médico 12/31/16 12 meses H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 16 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios MODAFINIL MODAFINIL Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios MOZOBIL MOZOBIL Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios MULTIPLE SCLEROSIS AVONEX, AVONEX PEN, BETASERON Todas las indicaciones médicamente aprobadas no excluidas de la Parte D 12/31/16 Declaración de respaldo del diagnóstico de parte del médico requerida 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 17 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios NINLARO NINLARO Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión NUPLAZID NUPLAZID Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Psicosis relacionada con la demencia, sin relación con las alucinaciones y los delirios asociados con la psicosis de la enfermedad de Parkinson. El diagnóstico de la enfermedad de Parkinson se hizo antes de la aparición de los síntomas psicóticos. El miembro tiene una puntuación de mini prueba del estado mental (MMSE) de al menos 21 puntos antes del comienzo del tratamiento. Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios 12 meses Año del plan H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 18 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ODOMZO ODOMZO Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. Embarazo El miembro tiene un diagnóstico de carcinoma de células basales (CCB) avanzado localmente. El miembro experimentó una recidiva de la enfermedad tras la cirugía o radioterapia, O el miembro no es un candidato para recibir cirugía o radioterapia. Para las mujeres con capacidad de reproducción, se descartó la posibilidad de embarazo mediante un resultado negativo de prueba de embarazo. 12 meses OPDIVO OPDIVO Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Diagnóstico de melanoma no extirpable o metastásico, y avance de la enfermedad luego de ipilimumab [Yervoy] y pruebas para la mutación BRAF V600 O diagnóstico de cáncer de pulmón metastásico de células no pequeñas (non-small cell lung cancer, NSCLC) escamosas con avance durante o luego de una quimioterapia basada en platino. 12/31/2016 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 19 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios OPSUMIT OPSUMIT Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 20 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios PRALUENT PRALUENT Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. El miembro debe tener una de las siguientes afecciones (con tratamiento por primera vez y continuación): 1) cardiopatía arteriosclerótica (atherosclerotic cardiovascular disease, ASCVD) clínica previa o evento cardiovascular (consultar la sección Otros criterios), o 2) hipercolesterolemia familiar heterocigótica (HFHe): Diagnóstico definitivo de hipercolesterolemia familiar (HF) (consultar la sección Otros criterios). Por primera vez: para miembros con ASCVD clínica previa o evento cardiovascular, se debe cumplir al menos uno de los siguientes requisitos: 1) nivel actual de LDL-C de 70 mg/dl o superior luego del tratamiento con una estatina de alta intensidad (por ejemplo, atorvastatin, rosuvastatin), 2) nivel actual de LDL-C de 70 mg/dl o superior con intolerancia a una estatina de alta intensidad Y si el paciente está tomando una dosis máxima tolerada de cualquier estatina, 3) nivel actual de LDL-C de 70 mg/dl o superior con contraindicación de estatina (consultar la sección Otros criterios) O intolerancia a cualquier otra dosis de dos estatinas, o 4) tratamiento reciente (es decir, dentro de los últimos 120 días) con otro inhibidor de PCSK9. Para miembros con HFHe, se debe cumplir al menos uno de los siguientes requisitos: 1) con ASCVD: consultar los requisitos para miembros con ASCVD previa que se indican anteriormente, 2) nivel actual de LDL-C de 100 mg/dl o superior luego del tratamiento con una estatina de alta intensidad (por ejemplo, atorvastatin, rosuvastatin), 3) nivel actual de LDL-C de 100 mg/dl o superior con intolerancia a una estatina de alta intensidad Y si el paciente está tomando una dosis máxima tolerada de cualquier estatina, 4) nivel actual de LDL-C de 100 mg/dl o superior con contraindicación de estatina (consultar la sección Otros criterios) O intolerancia a cualquier otra dosis de dos estatinas, o 5) tratamiento reciente (es decir, dentro de los últimos 120 días) con otro inhibidor de PCSK9. Continuación: respuesta al tratamiento de acuerdo con lo indicado mediante una reducción del LDL-C. Personas de 18 años o más Año del plan ASCVD clínica o evento cardiovascular definidos como síndromes coronarios agudos, infarto de miocardio, angina estable o inestable, enfermedad coronaria u otro procedimiento de revascularización arterial [por ejemplo, PTCA, CABG], accidente cerebrovascular con presunto origen arteriosclerótico, accidente isquémico transitorio, enfermedad arterial periférica con presunto origen arteriosclerótico, descubrimientos a partir de una angiografía de tomografía computarizada (Computed Tomography, CT) o cateterismo de manera consistente con la ASCVD clínica. El diagnóstico de HF debe H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 21 ser confirmado mediante una de las siguientes opciones: 1) confirmación genética: una mutación del receptor de LDL, apolipoproteína B100 familiar defectuosa o una mutación de ganancia de función del PCSK9, 2) criterios de diagnóstico del registro Simon Broome para la HF definitiva: colesterol total superior a 290 mg/dl o LDL-C superior a 190 mg/dl, además de xantoma de tendón en el paciente, familiar de primer grado (padres, hermanos o hijos) o de segundo grado (abuelos o tíos), o 3) criterios de la red holandesa de clínicas lipídicas (Dutch Lipid Clinic Criteria) para la HF definitiva: puntuación total mayor a 8 puntos. La contraindicación de estatina se tiene que deber a alguna de las siguientes opciones: 1) enfermedad hepática activa, incluidas elevaciones persistentes sin motivo en los niveles de transaminasa hepática (por ejemplo, nivel de ALT de al menos 3 veces el ULN), 2) mujeres que están embarazadas o pueden quedar embarazadas, o 3) madres lactantes. Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios REBIF REBIF, REBIF REBIDOSE, REBIF REBIDOSE TITRATION, REBIF TITRATION PACK Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico. Pacientes con un diagnóstico de esclerosis múltiple (EM) o que hayan experimentado un ataque y corran riesgo de padecer EM 12/31/16 REGRANEX REGRANEX Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Úlceras neuropáticas diabéticas: paciente diabético con úlcera. El tratamiento se brindará en combinación con el cuidado de heridas provocadas por úlceras (p. ej. desbridamiento, control de infecciones o alivio de la presión) Úlceras neuropáticas diabéticas: máximo de 5 meses. H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 22 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios REVLIMID REVLIMID Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida REXULTI REXULTI Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Declaración de diagnóstico por parte de la persona autorizada a dar recetas y documentación de prueba y falla, contraindicación o intolerancia a aripiprazole 12 meses RITUXAN RITUXAN Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 23 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios SILDENAFIL SILDENAFIL Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios SOMATULINE SOMATULINE DEPOT Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura SOVALDI SOVALDI Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Otros criterios 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 El paciente debe tener el genotipo 1, 2, 3, 4, 5 o 6 El paciente debe tener 18 años o más. La persona autorizada a dar recetas debe ser un gastroenterólogo, hepatólogo o especialista en enfermedades infecciosas 12, 16, 24 o 48 semanas con base en el genotipo, estado cirrótico, estado del trasplante, y terapia previa o continua. Para los genotipos 2, 3, 4, 5 y 6, los pacientes deben estar tomando ribavirin con Sovaldi. H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 24 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios STIVARGA STIVARGA Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios SUBOXONE BUPRENORPHINE HCL, BUPRENORPHINE HCL/NALOXON, SUBOXONE Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios TAGRISSO TAGRISSO Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D. 12/31/16 12 meses 12 meses H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 25 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios TARGRETIN BEXAROTENE Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida TRACLEER TRACLEER Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios Oncólogo 12 meses Diagnóstico definitivo de linfoma cutáneo de células T (cutaneous T-cell lymphoma, CTCL) Y resistente a cualquier tratamiento sistemático previo (como methotrexate). Declaración de respaldo del diagnóstico de parte del médico. El paciente actualmente no toma gliburida o ciclosporina. El paciente ha realizado exámenes iniciales de la función hepática (ALT, AST) antes del comienzo del tratamiento 12/31/16 XENAZINE TETRABENAZINE Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 26 Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios XTANDI XTANDI Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ZORBTIVE ZORBTIVE Todas las indicaciones médicamente aprobadas no excluidas de la Parte D Grupo de autorización previa Nombres de los medicamentos Usos cubiertos Criterios de exclusión Información médica requerida Restricciones de edad Restricciones de la persona autorizada a dar recetas Duración de la cobertura Otros criterios ZYTIGA ZYTIGA Todas las indicaciones aprobadas por la FDA no excluidas de la Parte D Prueba y falla de Zytiga 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 Declaración de respaldo del diagnóstico de parte del médico 12/31/16 H3347_2016 N.º de id. del formulario: 16195 Version 23 Actualizado: 10/01/2016 Fecha de entrada en vigencia: 10/01/2016 27