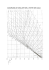Lixiviación con Acido Sulfúrico a Presión del Mineral de Níquel de
Transcripción
Lixiviación con Acido Sulfúrico a Presión del Mineral de Níquel de
LatinAmerican [ournal o/ Metallurgy and Materials, Vol 4, N° 1, 1984
Lixiviación con Acido Sulfúrico a Presión del Mineral de Níquel de Loma de Hierro
Elizabetta Orlandoni M. y Sergio Miranda C.
Escuela de Ingeniería Química, Universidad de Los Andes, Mérida-Venezuela
Se lixivia lateritas niquelíferas de Loma de Hierro (Estados Aragua, Miranda, Venezuela) con ácido sulfúrico a presión. la composición media de las muestras procesadas es: Ni 1.6%, Fe 38,6%, Co 0.15%, Mg 1.7%, Mn 0.7%, SiO. 13%. Se emplea un reactor discontinuo
de 2 litros que se carga con una pulpa de 45% de mineral y 55% de ácido sulfúrico diluido. La relación ácido a
mineral se determina
expresando
el ácido diluido como su equivalente
en H,S04 100%. Se determina Ni, Co, Mg, Mn y Fe
extraídos para relaciones ácido sulfúrico puro/mineral,
0.1,0.2 Y0.3 Ypara temperaturas
de 200, 230, 250 Y270 "c. El proceso
se controla analizando los cationes presentes en el licor de lixiviación y en el residuo sólido, por espeetrofotometría
de absorción atómica. El Ni, Co y Mn extraídos aumentan con la relación ácido sulfúrico puro a mineral. Para la relación ácido puro/
mineraldeO.3
se tiene una recuperaeióndel70%
de Ni, 80% de Co y 75% de Mn. El po rce ntaje de ácido consumido por el Ni, Co
y Mn para una relación ácido puro a mineral superior aO.1 e.s, aproximadamente,
17% del ácido alimentado.
Los sulfatos insolubles consumen cerca delSO% del ácido, independientemente
de la relación ácido puro a mineral. El resto del ácido es consumido por los sulfatos solubles de hierro y magnesia. Para tiempos de reacción mayores de 15 minutos y temperaturas
de 200 a
270 "C, el porcentaje
de extracción
del Ni, Co y Mn es función de la relación ácido puro a mineral, pero no de la temperatura.
Pressure Leaching of Nickel Mineral of Loma de Hierro by Sulfuric Acid
The experimentalleaching
process of the nickel- ferrous la terites from Loma de Hierro (Aragua Sta te, Venezuela) with sulphurie acid under pressure is studied. The ehemical analysis of the processed sa mplcs gave: Ni 1.6%, Fe 38.6%, CoO.1S%, Mg 1.7%,
Mn 0.7% and SiO, 13%. The temperature
and the reactíon time are changed mantaining a pulp of 45% ore and )5% diluited
sulphuric acid. The extracted quantities ofNi, Co and Mn increase with the H,SO-j-ore ratio. With a 0.3 ratio the recovery is
70% Ni, 80% Co and 75% Mn. From the feed sulphu ric acid, for acid-ore rat ios greater than 0.1, a \7% is consumed by Ni, Co
and Mn and 50% by prccipitation
()f basic sulphates, independently
from thc acíd-ore ratio .•Berween 200 and 270 nC, when
rea ctio n times are greatcr than 15 minutes, the extracted amount ofNi, Co and Mn are function of the acid-ore ratio and they
are temperature
independent.
1.
GENERALIDADES
2.
El mineral de Loma de Hierro (Estados AraguaMiranda, Venezuela), consiste, básicamente, en óxidos o mineral de lateritas niquelíferas, producto
típico de la meteorización tropical a consecuencia de
la hídrólisís progresiva de los minerales de la roca.
Estas tienen un elevado contenido de óxido de hierro
[1-5, 9, 10, 12, 13]. La exracción del níquel se ha
resuelto por dos caminos: la pirometalurgia y la
hidrometalurgia, teniendo ventajas la segunda sobre
la primera, ya que elimina el problema de contaminación ambiental. La hidrometalurgia consiste en el
calentamiento del mineral o concentrado con un lixiviante apropiado, de manera que se lixivien las metales deseados. El proceso debe ser selectivo y para ello
es necesario, también, trabajar a elevadas ternperaturas y presiones. La lixiviación con ácido sulfúrico a
elevadas presiones y temperaturas presenta las siguientes ventajas: selectividad máxima, reducción. de
consumo de ácido, licor de lixiviación con bajo contenido en hierro, con la consecuente sencillez en la
recuperación del níquel [5, 6, 8, 14].
ESTUDIO EXPERIMENTAL
Luego de la búsqueda del mineral, éste se seca,
muele y. cuartea hasta obtener una muestra total uniforme de grano entre 80-180 mallas. El mineral se
somete al proceso de lixiviación con ácido sulfúrico
diluido en proporción determinada, colocando la
mezcla en un reactor Parr de 2 litros. Las experiencias se hacen a diversas temperaturas y presiones, distintas proporciones de ácido sulfúrico y diferentes
tiempos de reacción, para estudiar la evolución de la
extracción del níquel. Una vez terminada la reacción,
se abre el reactor y se saca la masa lixiviada, lavándose
con agua y separándose, por decantación y filtración
posterior, el licor y el minerallixiviado, anotándose
el peso de ambos. Se analizan el licor y el minerallixiviado por espectrofotometría de absorción atómica,
determinándose níquel, hierro, cobalto, magnesio
y manganeso.
Se realizaron 31 experiencias, variando:
- Relación ácido sulfúrico puro/mineral, en
peso.
42
Revista Latinoamericana
- Tiempo
de Metalurgia y Materiales, Vol. 4, N° 1, 1984
de reacción.
3. RESULTADOS
- Temperatura,
y dejando constante
tor en:
El mineral original contiene, según análisis:
1.62% de Ni; 38.57% de Fe; 0.15% de Co; 1.74% de
Mg; 0.71% de Mn y 13% de Si02• Las Figs. 1,2 Y3 presentan los porcentajes en peso de extracción de los
cationes vs. tiempo de reacción a diferentes temperaturas, manteniendo la relación ácido sulfúrico puro/
mineral ~n 0.1. Las Figs. 4, 5, 6 Y 7 representan los
porcentajes de extracción de los cationes vs. tiempo
de reacción a diferentes temperaturas, manteniendo
la relación ácido sulfúrico puro/mineral
en 0.2. La
Fig.8 presenta los porcentajes en peso de extracción
de los cationes vs. tiempo de reacción a 230°C y con
relación ácido sulfúrico puro/mineral de 0.3. La Fig.
9 COmpara los porcentajes de Ni, Fe extraídos con
relación ácido sulfúrico puro/mineral de 0.1 y 0.2 a
270°C. La Fig. 10 compara los porcentajes de Ni, Fe
extraídos con relación ácido puro/mineral de 0.1; 0.2
Y0.3 a 230°C. La Fig. 11 muestra los porcentajes de
Ni extraídos vs. temperatura,
manteniendo
como
parámetro la relación ácido sulfúrico puro/ mineral a
un tiempo de reacción de 30 minutos.
la densidad de la carga del reac-
45% en peso de mineral seco.
55% en peso de ácido sulfúrico diluido.
La Tabla 1 resume las condiciones
les para cada ensayo.
experimenta-
La sílice se determina en el mineral original por
ataque con ácido nítrico concentrado.
TABLA
N° 1
LIXIVIACIONES PARA RELACIONES
ACIDO SULFURICO PURO A MINERAL
0.1,0.2 Y 0.3
CARGA DEL REACTOR:
.
Mineral seco 350 gr.
Acido Sulfúrico diluido 427.6 gr.
Experiencia
Temperatura
N°
°e
H2S02
Tiempo
Min.
Presión
Psig.
100% a MINERAL 0.1
17
18
19
20
230
230
230
230
15
30
60
90
500
500
500
500
21
22
23
24
250
250
250
250
15
30
60
90
620
620
620
620
25
26
27
28
270
270
270
270
15
30
60
90
800
800
800
800
4.
DISCUSION
4.1.
a.
De las Figs. 1 a 3 se observa que el porcentaje
máximo de extracción
de níquel es del
37.31%, que corresponde
a un tiempo de
reacción de 30 minutos, T= 270°C y relación ácido puro, mineral de 0.1. A ese
máximo de extracción corresponde un promedio mínimo de extracción
de hierro
(0.96%). Debe notarse que la extracción máxima de hierro (1.49%, t = 30 min, T =
250°C) corresponde a la máxima extracción
de cobalto (67.06%) y manganeso (75.57%),
mientras que el níquel se mantiene en un
promedio del 33.22%.
b.
De las Figs. 4 a 7 se observa un porcentaje
máximo de extracción de níquel (59.28%) a
t = 90 min, T = 250 °C y relación ácido puro/
mineral de 0.2. El máximo porcentaje de
extracción de hierro (9.12%, t= 30 min y
T= 250°C) corresponde al máximo de mag-
H,SO. 100% a MINERAL 0.2
1
2
3
4
250
250
250
250
30
60
90
15
620
620
620
620
5
6
7
8
200
200
200
200
15
30
60
90
220
220
220
220
9
10
11
12
230
230
230
230
15
30
60
90
500
500
500
500
13
14
15
16
270
270
270
270
15
30
60
90
800
800
800
800
30
15
90
500
500
500
H2S04
c.
100% a MINERAL 0.3
d.
29
30
31
230
230
230
43
Extracción
nesio (45.22%) y manganeso
(82,23%),
mientras que el cobalto se aproxima al
máximo (80.73%) y el níquel se mantiene en
un promedio del 57.27% de extracción.
La Fig. 8 muestra el porcentaje máximo de
extracción de níquel (70.55% t= 15 min,
T = 230°C y relación ácido puro/ VIÍneral de
0.3) al que corresponde una extracción del
6.8% de hierro.
La Tabla 2 compara los porcentajes
de
extracción de ruquel y hierro para relaciones
ácido/ mineral de 9.1 y 0.2 {Fig. 9) a la tempe-
Latin/imerican
[ournal
o/ Metallurgy and Materials, Vol. 4, N° 1, 1984
ratura máxima de operación (270°C). Con la
duplicación de la cantidad de ácido sulfúrico
puro utílízado, hay un aumento promedio de
extracción del 24% en níquel y del 3.5%
en hierro.
e. Latabla 3 compara los porcentajes de extracción de níquel y hierro a diferentes relaciones de ácido puro/mineral (Fig. 10) a230°C.
Con la triplicación de la cantidad de ácido
sulfúrico puro utilizado, la extracción del
níquel aumenta el 36% en promedio, mientras que el aumento promedio de extracción
de hierro es del 6.71%; al variar la relación
ácido/mineral de 0.2 a 0.3 hay un aumento
del 12% en extracción de níquel, y un aumento del 3.21% de extracción de hierro.
f.
Lo anterior debe considerarse tomando en
cuenta las siguientes condiciones de operación:
- Los tiempos de reaccion se midieron
desde el momento en que el reactor alcanzó la temperatura de trabajo hasta
que se desconectó el sistema de calentamiento.
- Desde que se inicia el calentamiento hasta
que se alcanza la temperatura de trabajo
transcurren cerca de 45 min,
- Desde que se desconecta la calefacción
hasta que la temperatura baja a 120°C,
transcurren cerca de 90 minutos.
La Hg. 11 representa los porcentajes de
extracción de níquel y hierro vs. temperatura con "t ~ 30 min y parámetro la relación
ácido sulfúrico puro/mineral. Se observa
que resultan líneas rectas de pendiente aproximadamente constante, cuyos valores son:
0.044% de extracción de Ni/oC y 0,01 % de
extracción de Fe/oC, las pendientes de las
rectas son bastante pequeñas, de donde se
deduce que la extracción depende de la relación ácido sulfúrico puro/mineral y es bastante independiente de la temperatura y del
tiempo de reacción, en el rango de temperaturas y tiempos de experimentación.
TABl.A
EXTRAeeION
N°
DE NIQUEL
Relación
100
T =230
{1j
'-
-;;60
w
--
:=
0.1
Mn
Co
--
11
"
\
"
,"
-
"
/
20 1 1
I
0.2
'1
mineral
o
'"
/
,,'
Aojo
Ni
v .....
I
A 270 "e
Mg
,- -
Fe
--15
30
60
~tJmin
t, min
Ni
Fe
Ni
Fe
15
30
60
90
29.53
37.31
34.99
35.80
0.95
0.96
0.97
0.97
58.95
56.23
57.76
56.64
4.51
4.72
5.05
5.08
Fig.l
-t: Extracción
Ni, Fe,Mg,Mn,
Co vs. Tiempo
TABl.A
EXTRAeeION
,
.;.-.--
'"
/,
~
0.1
e
c80
2
y HIERRO
o
-o
u
u
H2S04 /minera I
N° 3
DE NIQUEL
y HIERRO
A 230 "e
Acido
0.2
0.1
0.3
Mineral
1, min
Ni
Fe
Ni
Fe
Ni
Fe
15
30
60
90
34.59
34.53
30.63
30.24
1.07
1.36
1.30
1.36
52.87
56.32
59.08
57.80
4.54
4.90
5.00
4.59
70.5.5
69.36
6.80
64.38
9.44
44
7.34
90
Revista Latinoamericana de Metalurgia y Materiales, Vol. 4, N° 1, 1984
100 Relación H2S04/mineral
=0.1
H S0 Imineral
2 4
Relación
100
T=250°C
=0.1
T=270°C
I
I
e 80
o
u
u
ni
•...'-
"
/
I
w50
,
,.
I
!
Mn
-- •.. -
e
'o
u
Co
80
1.-••••.
I
.:: 6 O
x
I
, 1
I
"
'"
"
"
I
,,',
',. .•
,•.. •..
!..
--
Ni
,"
,
Mg
- --
20
,•..
"
-t;
II
1
/
'
30
15
60
--
Mg
Fe
-
90
O
15
Relación
~S04 Imineral
% Extracción
Relación
100
= 0.2
H S0 1m ineral = 0.2
2 4
T=230°C
./
-
,
,
u
, ,
ni
'-
,
('~
-, .
x
,
Mn
u
u
,,
, ""
I
"
60
~
I
" ,
l'" II
o
l'
,,''"
,
,/ ,,
20
,
Mq
..-
1
~' ,.
20
""
,~
,.,
I
1,
1,·,
o
,
, ...
,
1,
"/
I
Mg
n,t
"
,,'
, "
/1
~
"
"".
...
,,
"'
I
x
W
••.•
"
,
(!S
Ni
Co
,',
e,
'o
I
'
,"
'/
/,
,
I
,~ .•..----
80
I
w 50
NiJ FeJMgJMnJ
Co vs.Tiempo
T = 200°C
u
90
t.rnin
Co vs. Tiempo
100
60
30
~
t,min
Ni, Fe,Mg, Mn,
Extracción
I~
,,- -
I
,/ "
'1
,""
Fe
Fig.2
i
," I
"
-
o
I
"
/
"
20
, •..
I
1
I
I ,
Co
,
,,
,,
w
I
I
-,
Mn
,,
u
ni
'1
- ..
,
Fe
.
15
I
.'
30
60'X,
~
-t:
---
O
90
Fe
.
15
30
t.rnin
Fig.5
Extraccion:Ni,FeJMgJMn,
% Extracción:
60
45
tJ min
Ni JFeJMgJMn,
Co vs Tiempo
Co vs. Tiempo
90
f ourna]
Latin American
o/ Meta/!urgy
and Materia/s,
Relación H2S04/mi neral =0.2
T = 250° C
100
l
80
1,
1,
e
. 'o
'(3
u
ru
x
w
,
o
,.
I
"
Mn
e
Co
~~80
u
, I
,/
1
.,
"
,
60
30
-
o
90
15
-
H2S04 1m ineral
Relación
=0.3
T = 270°C
100
T= 230°C
&~
+'
x
W
~
/'7
,
1
,
60
I
~
Ni
I
I
~
1
~
: ' .. -- <,
,"
"
"
,
~ 60
,,,
,
!
¡
20
,
I
Fe R=O.l
I
,
-t: Extracción
".
·v.
/
Fe R=0.2
11
30
. '"
"."
/
I
,'
, - ,--
Fe
.>
15
-
, I
~
Fig.8
...- ,,
,
,
Ni R = 0.2
II
1
I
o
,
I
,
,,,
20
,,
I
,,¡...
w
~
,.
H2S04 Imineral
R =Relación
Co
~
t,min
Ni,Fe,Mg,Mn,
Co vs Tiempo
e
'o
~ 80
90
% Extracción:
Co vs Tiempo
100
60
30
trnin
010 Ext racción: Ni,FeJMgJMnJ
Fig.6
Fe
-
,, ,
.....
15
1
I
,, -
_1---- ---
o
1
,//
Fe
..•.•. .",.
I
11.1
20
Mg
I
/
,,1
1
--
,. ",
'It
'11
,,,
,
~"
,
I
I
1/ 11 I
,,1,
"
"
Ni
,
"
,,,,
) 40 v¡" , /
20
Mn
1
u
Mg
l' : -- , --
;;-
Co
..
, ,,
tI., .
--
=0.2
T=270°C
"
'1,
'1
,1,
Relación H S0 Imineral
2 4
100
~
"
~ 60
Vol 4, N" 1, 1')84
60
__
t.rnin
o
90
Fig.9
Ni,Fe,MgJMn,
Co vs Ti empo
46
/
11'
- 15
30
60
90
~
t,min
% ExtracciónNi,Fe
con diferentes
Relaciones H2S04/mineral
Revista Latinoamericana
de Metalurgia
T,. 230°C
100
y
Materiales, Vol. 4, N' 1, 1984
100 Tiempo de reacción, t = 30 min
R = Relación HZS04/mineral
R =Relación H S04 / miner
Z
e
'o
u
~
•....
-+-"
x
W
I
;f 60
"
,
".
I
I
-- -
Ni, R=O.l
I
,,
I
I
/
NI,I"<=U.L
I
1
40
Ni, R=O.l
!
I
I
Fe,R FO.3
I
I
I,
w 60
;f
/
I
I
~
x
I
I
I
20
--
-
I
I
I
I
I
Ni, R=0.3
Ni R=0.2
--
I
u
u
/
I
I
I
-,,- ,
I
,.,._-
---
Fe R=0.2
o
15
Fig.lO
60
---,.;>
t,min
1--
Fe, R=0.2
o
90
Fe R=O.l
200
Fig .11
% Ext racción Ni,Fe con diferentes
Relaciones
._--------
~'--"-""
/
VIY
30
----
20
Fe,R 0.1
L
LJ"';::::' -
4.2.
I
,~ 80
80
1
1
H S04/ mineral
Z
230
250
270
---T,oC
% Extracción
Ni,Fe vs Temperatura con tiempo de reacción de 30min
Consumo de ácido
TABLA
Se titula el licor de lixiviación para determinar el ácido residual luego de la extracción, esta
titulación indica que el 00% del ácido sulfúrico
se ha consumido: el licor de lixiviación está a un
pH aproximadamente
neutro. El equivalente en
ácido sulfúrico de los sulfatos en el licor de lixiviación, es inferior al ácido alimentado al reactor, es decir, parte de los sulfatos han permanecido insolubles en el residuo sólido. La formación de sulfatos insolubles en soluciones neutras, se menciona en trabajos sobre la extracción
de níquel (15), y como principal componente se
cita el Fe(OH)S04' que se formaría de acuerdo a
la ecuación:
N° 4
CONSUMO DE ACIDO
í
ACIDO A MINr.RAL 0.1
T, °C
200
230
2;0
270
%
%
%
22
12
9
35
12.5
10.5
30
10
9
57
42
51
18
44
14
17
24
7
17
24
9
56
50
24
51
(Ni, Co; Mn¡S04
Fel(S04)¡
Mg(S04)
Sulfatos
insolubles
ACIDO A MINERAL 0.2
Fe2(S04)3
+ MeS04
donde Me
+ H20 + MeO ---.
=
Ni,
2Fe(OH)S04
+
(Ni, Co, Mn)S04
Fe,(S04)'
Mg(S04)
Sulfatos
insolubles
ce, Mn, Mg.
En la Tabla4 pueden observarse los porcentajes promedios de ácido sulfúrico que consumen los: sulfatos insolubles y sulfatos de hierro,
níquel, cobalto, manganeso y magnesio, para las
relaciones ácido sulfúrico puro! mineral de 0.1;
0.2 Y0.3 Y temperaturas de 200,230,250
Y 270
grados centígrados,
calculados a partir de los
balances en sulfato.
17
20
ACIDO A MINERAL 0.3
(Ni, Co, Mn)SO.¡
Fe,(S04);
Mg(S04)
Sulfatos
insolubles
47
16
24
5
55
8
Latin Amcrican [ourna! of Metli!lllrgy
La formación de sulfatos insolubles compite
directamente con la formación de los sulfatos
solubles de hierro y magnesio, mientras que el
porcentaje de ácido consumido en la extracción
de los sulfatos de níquel, cobalto y manganeso se
mantiene aproximadamente constante. La formación de sulfatos insolubles se favorece cuando
el ácido reaccionante está en cantidad limitada,
ya que la solución se neutraliza rápidamente y
hay competencia con la formación de sulfatos
solubles. También debe influir el tiempo que
transcurre entre la descarga del reactor y la filtración y lavado del residuo sólido. Al dejar en
contacto la solución de lixiviación con el residuo
sólido a temperatura ambiente, el ácido residual
reacciona con parte del óxido de hierro, pasando
a sulfato de hierro solubles; al agotarse el ácido,
en ambiente neutro, entra a actuar el equilibrio:
and Materials,
BIBLIOGRAFIA
lo que se traduciría como paso de sulfato de la
fase soluble a la insoluble.
1.
Bateman, A. M.:
Wiley (19~1).
2.
Bellizia, G. A.: Rocas ultrabásicas en el sistema montañoso
del Caribe y yacimientos minerales asociados, Boletín de
Geología, Edit. Sucre, Caracas (1967).
3.
Bellizia, G. A.: Yacimientos de níquel en Venezuela, Ministerio de Minas e Hidrocarburos,
Informe Inédito, Caracas.
4.
Bowen, N. L. Y Tuttle, O. F.:
Geo!. Am., Bull. 60 (1949).
5.
Canterford,). H.: The extractive metallurgy of níckel, Rev.
Pure and Appl. Chem. 22 (1972) 13.
6.
Dana, E. S.:
7.
Faust, G. T.: The hydrous nickel-magnesium
silicates- The
garnierite- group, Amer. Min. Bull., 51 (1966) 3.
8.
Fisher, R. B. Y Dressel W. M.: The Nicaro (Cuba) nickel
ores; basic studies, including differential thermal analyses in
controlled
atmospheres,
U. S. Bur. Mines Rept., Inv.
5496 (1959).
9.
Harrison, J. B.: The katamorphism
of the igneous rocks
under humid tropical conditions, Thos. Murby & Co., London (1933).
El níquel, cobalto y manganeso extraídos,
aumentan con la relación ácido sulfúrico
puro! mineral.
Para una relación ácido puro! mineral de 0.3,
se recupera un 70% del níquel, un 80% de
cobalto y un 75% de manganeso.
c) El porcentaje de ácido consumido por el
níquel, cobalto y manganeso, cuando la relación ácido! mineral es superior a 0.1, es de
aproximadamente el 17% del ácido alimentado.
d) Los sulfatos insolubles consumen cerca del
50% del ácido alimentado, independientemente de la relación ácido!mineral.
e) Entre 200°C y 270°C, para tiempos de reacción mayores de 15 minutos, el porcentaje
extraído de níquel, cobalto y manganeso es
función de la relación ácido! mineral, pero
no de la temperatura.
En
un reactor por cochadas, el tiempo de
f)
reacción estaría determinado por los períodos de calentamiento y enfriamiento. En
caso de un reactor continuo, él no superaría'
los 15 minutos.
Textbook
formation
of mineral
deposits,
The sistem MgO-Si02-H20,
of Mineralogy,
Wiley (1932).
Hess, H. H.: Serpentines, orogeny and epirogeny,
Soco Am., Sp. Paper 62 (Crusr of (he Earth) (1955).
Geol.
11.
Kerr, P.: Hydrothermal
alteration and weathering,
Soco Am., Sp. Paper 62 (Crust of the Earth) (1955).
Geol.
12.
Momoya,].
W. y Baur, G. S.: Nickeliferous serpentines,
chlorites and related minerals found in two lateritic ores,
Am. Min., Bul!. 48 (1963) 11.
13.
Pec~ra, W. T.: Nickel-silicates and associated níckel-cobalt-manganese-oxide
deposits near Sáo Jose de Tocatins,
Goiaz, Brasil, U. S. Geo!. Surv., Bul!. 935-E (1944).
14.
Rey, M.: La Metallurgie des minerais oxidés de níckel, De
Ingenieur, 83 (1971) 45.
15.
Young, K. A.; Zubrycyj, N.; Evans, D.). 1. Y Mackiw, V.
N.: A Sulphation- Leach Process for Recovering nickel and
cobalt from laterites ores, 8th Commonw. Min. M,etall.
Congr. Australia N. Z., Tech. Session 3, preprirrt N° 76,
2-11 (1965).
b)
48
The
10.
CONCLUSIONES
a)
Vol. 4, N° 1, 1984