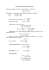Ejemplo 18 Si queremos disolver un precipitado de carbonato
Transcripción
Ejemplo 18 Si queremos disolver un precipitado de carbonato
... .. .. . .. Ejemplo 18 Si queremos disolver un precipitado etc,) ácido fuerte (HCI, H2S04' 4,3, 10-7, Ka = .. .. .. .. .. . .. .. , Ks = [Ca2+] [CO~-] C03 2- + + 2 H qH2C03 que está poco disociado como indica su Ka' con lo que la [CO~-] ha disminuido, y el equilibrio se desplaza hacia la derecha disolviéndose el precipitado de CaC03, Además el H2C03 se volatiliza H2C03 qC02 según la reacción: (g) + H20 De esta manera también hidróxido magnésico: .. .. . al añadir el ácido fuerte se forma: .. .. . un de + CO~- .. .. . .. cálcico, añadiremos el ácido carbónico Al añadir un ácido fuerte: .. ... (s) qCa2+ CaC03 de carbonato para formar se pueden disolver Mg (OH)2 (s) qMg2+ 2 H++ 2 OH-q2 precipitados básicos como el + 20H- H20 de constante de disociación muy baja y por tanto retira los iones OH-, con lo que el equilibrio de precipitación siguiendo la ley de Le Chatelier se desplazará hacia la derecha, disolviéndose el precipitado, Formación de una base débil El mecanismo es igual que el del proceso anterior, el caso más típico es el de disolución de algunos hidróxidos en sales amónicas, El ion OH- se elimina por formación del hidróxido amónico de Ka = 5,5,10-1°. NH4 + + OHPor tanto, el hidróxido de magnesio cloruro amónico con lo que: Mg(OH)2 q NH40H se podría haber disuelto (s) qMg2+ también añadiendo + 20H- NHCI4 ~ NH4 + + CI2 OH- + 2 NH4 + q2 NH40H Desaparecen los iones OH- del equilibrio de precipitación, hasta el punto de que no se alcanza el Ks del hidróxido por lo que éste se disuelve o no precipita. Formación de un ion complejo estable 11 Otro método bastante utilizando para disolver ción de iones complejos estables. I De esta forma se pueden I f' ~ -- disolver precipitados precipitados es mediante de AgCI, Agl, etc. la forma-