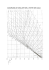5. ácidos sulfúrico y fosfórico. fertilizantes
Transcripción
5. ácidos sulfúrico y fosfórico. fertilizantes
5. ÁCIDOS SULFÚRICO Y FOSFÓRICO. FERTILIZANTES 1. PROPIEDADES Y APLICACIONES DEL ÁCIDO SULFÚRICO El ácido sulfúrico es el producto químico de mayor producción-consumo, que a escala mundial supera la cifra de 150 MTm/a. Su utilización industrial es debida a dos importantes propiedades: S su carácter fuertemente ácido, cuando está diluido en agua (concentraciones del orden del 1- 5 %w, para que se disocie el segundo protón) S su poder deshidratante, cuando está concentrado (concentraciones superiores al 80%w, preferiblemente >95%); además su precio es bajo. Se comercializa en un mercado globalizado muy transparente, casi siempre mediante contratos a largo plazo entre grandes productores y grandes consumidores. Los consumidores más importantes son los productores de ácido fosfórico (sector agroquímico), que aseguran su aprovisionamiento produciéndolo en plantas contiguas. Se emplea como reactivo en la fabricación de numerosos productos químicos (fertilizantes, explosivos, fibras sintéticas, etc.) y en la industria metalúrgica, tanto en los procesos de purificación o refino (cobre, zinc, etc.) como en operaciones de decapado. Se comercializa con concentraciones comprendidas entre el 98 y el 99 %w, como se produce. También se comercializan disoluciones de anhídrido sulfúrico (SO3) en ácido sulfúrico, que reciben el nombre de oleum (antiguamente ácido sulfúrico fumante, pues humea cuando sus vapores de SO3 se ponen en contacto con la humedad del aire). La concentración del oleum se expresa habitualmente como concentración en peso del SO3 libre disuelto en la mezcla, pero también se expresa como la relación (en forma de porcentaje) entre el peso del acido sulfúrico 100%, que se puede obtener mediante la adición de agua, y el peso inicial del oleum. Evidentemente, el agua no se adiciona realmente, sino que se determina mediante cálculo, para convertir el SO3 disuelto en H2SO4. Conversión de concentraciones del oleum mediante balance de SO3 y H2O para producir H2SO4 100%. %SO3 libre H2O necesaria H2SO4.formado %H2SO4 % H2SO4. Total 20 20 18 = 4,5 80 24,5 80 104,5 60 60 18 = 13,5 80 73,5 40 113,5 18 = 22,5 80 122,5 0 122,5 SO3 líquido 100 100 El ácido sulfúrico diluido a concentraciones por debajo del 94% sólo se comercializa en 5.2 TECNOLOGÍA QUÍMICA INDUSTRIAL circunstancias muy justificadas (ácidos residuales de diversos tratamientos). En general se prefiere transportar ácido concentrado y diluirlo en el lugar de su utilización por problemas de corrosión y para evitar sobrecostes del transporte de agua. 190 180 170 160 150 140 130 120 80 70 1.800 1.700 1.600 70 60 1.500 60 50 1900 . 3 90 50 1.400 40 1.300 30 20 1.200 10 0 10 1.100 -10 0 1.000 40 30 20 -20 % H2SO4 Temperatura ºC 100 Oleum 30 % SO3 40 20 10 100 90 80 Peso específico kg/m 110 900 -30 -40 800 Fig. 5.1. Ábaco de puntos alineados que relaciona la densidad del ácido sulfúrico con su concentración y su temperatura. El ácido sulfúrico presenta una serie de azeótropos a concentraciones próximas al 98,5 %w, a las que su presión de vapor se hace mínima. Tal y como se pone de manifiesto en la figura 5.2, los vapores del H2SO4 a concentraciones por debajo de esta concentración son de agua ácida, mientras que por encima (y especialmente en el caso del oleum) son de SO3 húmedo. En ambos casos el H2SO4 presente forma gotas diminutas (vesículas) cargadas electroestáticamente; es decir, nieblas persistentes, difícilmente condensables. Ácidos sulfúrico y fosfórico. Fertilizantes 350 5.3 [ºC] 340 ºC P = 1 ata T 300 250 Temperatura 200 150 100 50 43ºC 98,3-98,6 % 0 0 20 5ºC 40 60 80 100 122,5 Concentración H2SO4 %w 0 20 60 100 Oleum %w SO3 Fig. 5.2. Diagrama de equilibrio del ácido sulfúrico a presión constante. Almacenamiento y transporte. Materiales. El ácido sulfúrico se transporta en buques tanques de hasta 20,000 Tm, en camiones cisterna y cisternas sobre ferrocarril, además de bombearse por tuberías. Se almacena en tanques de capacidad de hasta 6.000 Tm, aunque no existe legislación que la limite. Los mayores suelen ser cilíndricos de fondo plano y techo cónico. Deben disponerse dentro de cubetos de hormigón con revestimiento antiácido, capaces de resistir las aguas ácidas de lluvia que pudieran ocasionarse accidentalmente y que proporcionen un cierto aislamiento con respecto a la circulación de vehículos que pudieran impactar con ellos, pero no para retener las fugas en el poco probable caso de rotura de los tanques. Deben disponer de sistemas de respiración y ventilación de la atmósfera presente en su interior, pues el hidrógeno producido por ataque del ácido al acero puede concentrarse y ocasionar atmósferas explosivas. Se recomienda realizar frecuentes transvases para evitar que la superficie del líquido quede estacionaria durante mucho tiempo y ocasione corrosiones muy localizadas en las paredes de los tanques, si la zona superficial del ácido se diluye debido a la humedad del aire. Para ácido frío (T < 40 ºC) y concentraciones superiores al 94% se admite el acero al carbono como material de construcción idóneo para tanques, cisternas y todo tipo de recipientes, previendo 5.4 TECNOLOGÍA QUÍMICA INDUSTRIAL un sobrespesor para la corrosión de 3 mm sobre los espesores que proporcionan la necesaria rigidez y resistencia mecánica. En tuberías, para las mismas temperaturas y concentraciones, se recomienda que las velocidades medias de circulación del ácido sean del orden de 1 m/s, y que nunca sobrepasen 1,5 m/s; para temperaturas superiores y las mismas concentraciones, el acero al carbono debe ser sustituido por fundición antiácida (con alto contenido de silicio), con uniones mediante bridas, juntas de teflón y tapajuntas protectores. En la construcción de recipientes se emplea el acero al carbono con un revestimiento interior de ladrillos antiácidos que aísle térmicamente las paredes metálicas, manteniendo su temperatura por debajo de los 40 ºC 200 Temperatura T [º C] VIDRIO 150 p. d Tem RFGP 100 lici bul e e GRAFITO ón TEFLON HASTELLOY B -2 PVDF Ferrosilicio 50 AISI 316L (con protección anódica) 0 10 20 30 40 50 Concentración 60 70 80 90 100 % w H2SO4 Acero al carbono 110 122,5 Fig. 5.3. Materiales resistentes al ácido sulfúrico según su concentración y temperatura. Para concentraciones inferiores a 78% y temperaturas de hasta 125 ºC se recomiendan materiales termoplásticos tipo PVDF o poliéster reforzado fibra de vidrio (FGRP). Cuando es necesaria una buena conductividad térmica pueden servir los aceros inoxidables AISI 316L (bajo carbono), 327 y/o 347 (estabilizados con Ti y Nb, respectivamente). A temperaturas hasta 100 ºC debe recurrirse a una protección catódica adecuada a las condiciones de servicio. Para temperaturas aún mayores en el mercado se encuentran aleaciones especiales como las que se indican en la figura y en casos extremos hay que recurrir al grafito aglomerado con resinas furánicas o al acero carbono vitrificado y/o revestido con teflón en su superficie en contacto con el ácido. Dilución del ácido sulfúrico con agua La entalpía de mezcla del ácido sulfúrico con el agua es muy grande, de modo que la temperatura puede elevarse por encima de la de ebullición de la mezcla, especialmente cuando la Ácidos sulfúrico y fosfórico. Fertilizantes 5.5 agitación no es buena. En tales circunstancias, se ocasionan recalentamientos locales con arrastres de líquido y proyecciones muy peligrosas al exterior del recipiente donde tiene lugar la mezcla. Los cálculos de las temperaturas finales de las mezclas pueden realizarse gráficamente sobre diagramas entalpía - composición - temperatura como el de la figura 5.4, que utiliza como origen de entalpias las del agua y del SO3 a 0 ºC. La mezcla de dos corrientes corresponde a un punto intermedio del segmento que une los puntos representativos de cada componente y se atiene a la ley de la palanca. Las unidades de dilución deben diseñarse mezclando ambos componentes en una cabeza mezcladora con una corriente de ácido diluido frío que rebaje la temperatura de la mezcla, seguida de un refrigerante de la mezcla de las tres corrientes, como se indica en la figura 5.4. Ambos equipos se construyen habitualmente en grafito aglomerado con resinas furánicas y se comercializan por empresas especializadas para distintas capacidades de dilución. PC PW AS 72 cwr cws S 98,6 % S 72,0 % Fig. 5.4. Diagrama simplificado de una unidad típica de dilución de ácido sulfúrico. Ejercicio 7.1. Una planta de dilución de ácido sulfúrico (según el diagrama simplificado de la figura 5.3) debe ser capaz de producir 25 Tm/h de ácido sulfúrico de concentración 72,0 % a partir de ácido sulfúrico del 98,6 % y agua, ambos a 25 ºC. Se dispone de agua de refrigeración que se suministra a 25 ºC y se retorna a 35 ºC. La instalación consta de los siguientes equipos principales: una cabeza mezcladora y dos refrigerantes dispuestos en serie construidos en grafito aglomerado (con un coeficiente de 5.6 TECNOLOGÍA QUÍMICA INDUSTRIAL Fig. 5.5. Diagrama entalpía - concentración del ácido sulfúrico y del oleum. Ácidos sulfúrico y fosfórico. Fertilizantes 5.7 transmisión de calor en los refrigerantes es 750 kcal/hm2ºC); dos recipientes de nivel constante; una bomba de alimentación del ácido sulfúrico concentrado, otra para el ácido diluido reciclado y una tercera para el envío del ácido diluido, y tres rotámetros (para acido fuerte, agua de proceso y ácido diluido). La temperatura del ácido a la entrada al primer refrigerante debe ser 90ºC y a la llegada al depósito de ácido diluido 35 ºC. Determinar: los caudales de las tres corrientes a mezclar y de agua de refrigeración y calcular la superficie de intercambio de calor que deben tener los dos refrigerantes de grafito. Solución: Balance de masa: Resulta: Global 25.000 (mezcla) H2SO4 25.000×0,72=18,000 S = 18.256 [kg/h] Y 10 [m3/h] Balance entáplico global: Entran: S 98,6 a 25 ºC A a 25 ºC R a 35 ºC Total Salen: M 72,0 a 35 ºC Calor a eliminar: = = S (ácido98,6) + A (agua) 0,986 S A = 6.744 [kg/h] Y 6,74 [m3/h] 18.256×(-198) 6.744×25 R ×(-205) = = = = (25.000 + R)(-205) = Caudal de agua de refrigeración de 25 a 35 ºC [kcal/h] -3.614.680 168.600 -205R -3.446.080 - 205R -5.125.000 - 205R 1.678.920 = mCW (35-25) mCW = 168 [Tm/h] Y 168 [m3/h] Cálculo del caudal de ácido diluido que debe reciclarse: Si no hubiera reciclo de ácido débil, la temperatura de la mezcla del agua y el ácido de 98,6 % sería, según el diagrama de entalpía - concentración: 170 ºC. Nota: puede aplicarse la regla de la palanca o hacer el siguiente balance entálpico: [kcal/h] Entran: S 98,6 a 25 ºC 18.256×(-198) = -3.614.680 A a 25 ºC 6.744×25 = 168.600 Salen: 25.000 h = -3.446.080 Se obtiene: h = 137,8 [kcal/kg], y en el diagrama de la figura 5.4: T =170 [ºC] Como debe salir a 90 ºC (h = 179 kcal/kg) debe ceder: 25.000(179-137,8) = 1.030.000 [kcal/h] al ácido reciclado que se calienta de 35 a 90 ºC: R(205-179) = 26R 26R = 1.030.000 Y R = 39.600 [kg/h ] con una densidad a 35 ºC de 1,625 (fig. 5.5) corresponde a un caudal de 24,38 [m3/h]. Área de la superficie de intercambio térmico: Q = UA∆T = 1. 678.912 [kcal/h] ( 90 − 35) − (35 − 25) 55 − 10 con: U = 750 [kcal/hm2ºC] y ∆T = = = 26,4 [ºC] 90 − 35 ln 5 , 5 ln 35 − 25 Resulta: A = 84,8 [m2] 5.8 TECNOLOGÍA QUÍMICA INDUSTRIAL 2. MATERIAS PRIMAS DEL ÁCIDO SULFÚRICO. AZUFRE Y MINERALES SULFURADOS El ácido sulfúrico se produce mayoritariamente a partir del azufre elemental, pero además es un subproducto importante de la industria metalúrgica que utiliza como materias primas menas de sulfuros de cobre (piritas y calcopiritas), de zinc (blendas), mercurio (cinabrio), plomo (galenas), etc. y otros complejos. El azufre procede de la desulfuración de los hidrocarburos del petróleo y del gas natural. En las refinerías de petróleo se obtiene en grandes cantidades en las denominadas unidades Claus, por reacción del sulfuro de hidrógeno (que es el compuesto estable resultante de la hidrodesulfuración de las diversas fracciones del crudo petrolífero) con el anhídrido sulfuroso (que es producto resultante de la combustión parcial de sulfuro de hidrógeno): H2S + 3/2O2 2 H2S + SO2 6 SO2 + H2O 6 3S + 2 H2O El azufre Claus se maneja y almacena casi siempre fundido y es de gran pureza (color amarillo). También se encuentra el azufre elemental en la naturaleza en grandes depósitos de origen volcánico, algunos relativamente someros, otros a grandes profundidades. Su deposición se produjo como consecuencia de reacciones similares a las de las unidades Claus a partir del sulfuro de hidrógeno originado en las erupciones volcánicas. De tales depósitos se extrae mediante calentamiento hasta la fusión (proceso denominado Calcarone desarrollado en Sicilia). El azufre fundido se solidifica en lingoteras produciendo un azufre parcialmente cristalino; también se sublima de modo que los vapores, al enfriarse, condensan en capas de polvo amorfo conocido como flor de azufre, también de color amarillo. Está prohibido transportar el azufre en polvo y en “todo uno” por el peligro de deflagración de las suspensiones de polvo de azufre en el aire; sólo se puede transportar a granel en lingotes o, mejor, fundido en tanques calefactados (como los asfaltos). El azufre de los depósitos a grandes profundidades se extrae con una técnica conocida como Frasch, que consiste en la perforación de pozos de pequeño diámetro similares a los de extracción del crudo del petróleo, pero entubados con dos tubos concéntricos. Por el tubo exterior se inyecta agua caliente o vapor de agua a presión, que funde parte del azufre del depósito, haciéndole salir a la superficie a través del tubo interior; inmediatamente se le depura mediante decantación, tanto de los fangos acuosos, como de los hidrocarburos, con los que aparece casi siempre contaminado (su color es negro). Las masas de sulfuros metálicos se explotan preferiblemente en cortas a cielo abierto, removiendo la capa de tierra que las cubre (montera). La parte superior de los yacimientos complejos de cobre, zinc, plomo, etc. suele estar muy oxidada (sulfatos en vez de sulfuros) y puede contener concentraciones apreciables de metales nobles, como consecuencia de la disolución parcial y arrastre por el agua de lluvia de los sulfatos de los metales ligeros. Los distintos sulfuros metálicos se separan entre sí y de la ganga mediante distintos métodos, entre los que destaca la flotación con distintos agentes tensoactivos, generando concentrados que se benefician por separado. Ácidos sulfúrico y fosfórico. Fertilizantes 5.9 Los sulfuros se tuestan con aire generando anhídrido sulfuroso SO2, algo de anhídrido sulfúrico SO3 y los óxidos metálicos correspondientes, que se reducen a metal mediante distintos procesos. Uno de los procedimientos más utilizados es la electrólisis. El mineral más rico en azufre (48 %) es la pirita (Fe S2) que forma cristales cúbicos con un átomo de azufre lábil en el centro de cada cubo. Fe S2 + O2 Y Fe3O4 + Fe2O3 + SO2 + (SO3) Algunos átomos de azufre están sustituidos por átomos de arsénico, selenio y teluro, mientras que los de hierro por átomos de cobre, zinc, plomo y otros metales. Sin embargo en la actualidad se emplea muy poco para la fabricación de ácido sulfúrico por no resultar económicamente rentable el beneficio del hierro, puesto que el óxido resultante de su tostación contiene muchas impurezas y precisa complejos y costosos tratamientos de purificación. El azufre sólido presenta dos variedades cristalinas alotrópicas: el azufre α (rómbico), estable a la temperatura ambiente, y el β (monoclínico) que a la presión atmosférica es estable entre 95 y 119 ºC. Además el azufre se encuentra en estado metaestable amorfo, cuando el fundido se enfría rápidamente. Presión de vapor de azufre En estado vapor coexisten diversas asociaciones atómicas del azufre (S2, S4, S6, S8, etc.) con lo que la masa molecular media resulta muy superior a 64 g/mol. En estado líquido también coexisten al menos dos tipos de asociación o fases: la λ, de baja viscosidad, y la µ de una viscosidad quince veces mayor. Por ello, al calentar el azufre fundido por encima de 150 ºC se produce un enorme aumento de la viscosidad en el intervalo de 157 a 187 ºC, coincidente con un cambio de color de amarillo a pardo. En la manipulación del azufre líquido debe cuidarse de no sobrepasar la citada temperatura límite de aparición de la fase µ de 157 ºC. Fase sólida α Fases líquidas λ y µ Fase sólida β Líquido subenfriado le taestab α me Fase vapor 95 Fase vapor 112 Temperatura 119 T [ºC] Fig. 5.6. Diagrama de fases del azufre El azufre fundido se quema con aire seco en mecheros similares a los utilizados para el fuelóleo. Los gases sulfurosos producidos en la combustión del azufre son incoloros, pero forman grandes nubes blancas en el aire húmedo debido a la formación de nieblas de ácido sulfúrico resultante de 5.10 TECNOLOGÍA QUÍMICA INDUSTRIAL la reacción del anhídrido sulfúrico con el vapor de agua según la ecuación: SO3(g) + H2O(g) Y H2SO4(vesicular) Las vesículas de ácido sulfúrico están cargadas de electricidad estática y se repelen entre sí, por lo que su coalescencia está muy dificultada; sin embargo, en la atmósfera se descargan y llegan a condensar, produciendo lluvia y condensaciones fuertemente ácidas. En la fabricación del ácido sulfúrico la absorción de SO3 debe hacerse con ácido sulfúrico concentrado (con la mínima tensión de vapor de agua, es decir con el azeótropo de concentración 98,6 %), que remonta su concentración hasta alrededor del 100 % y, seguidamente se diluye este ácido con agua para ponerlo otra vez a la concentración del azeótropo. 3. PROCESO DE FABRICACIÓN DE ÁCIDO SULFÚRICO A PARTIR DE AZUFRE El proceso de fabricación más empleado en la industria puede esquematizarse en el diagrama de bloques de la figura 5.7 y en simplificado de flujos de la figura 5.8. Fig. 5. 7. Diagrama de bloques del proceso convencional de fabricación de ácido sulfúrico a partir de azufre. El aire de combustión se seca en una torre regada con ácido sulfúrico de concentración 94 - 96,5 %, que se diluye. La combustión se produce a 900 ºC y es prácticamente completa y con los gases de combustión se genera vapor de agua en una caldera de recuperación de calor. La mezcla de gases (SO2, O2, N2 y algo de SO3) se enfría hasta 450 ºC y entra en la unidad de conversión al reactor adiabático con cuatro lechos catalíticos de pentóxido de vanadio, enfriándose entre etapas sucesivas Ácidos sulfúrico y fosfórico. Fertilizantes 5.11 para maximizar el grado de conversión. Los gases salientes de conversión, con un contenido mínimo de SO2 entran en la torre de absorción regada con ácido sulfúrico del 98,6 %. Este ácido aumenta su concentración y se diluye con ácido del circuito de secado para recircularlo a través de un refrigerante. Como el ácido de secado se debilita con el agua del aire, se refuerza con ácido concentrado del circuito de absorción. Se dispone de un sistema de bombas y tuberías para realizar esta transferencia de ácidos débil-fuerte. El agua necesaria se añade ál ácido en algún punto de este sistema transferencia. Ejercicio 5.2. En una planta de fabricación de ácido sulfúrico a partir de azufre se seca una corriente de aire atmosférico en las condiciones de saturación a 25 ºC hasta un contenido de humedad despreciable. El secado se realiza en una torre rellena y en contracorriente con un caudal de 56.885 kg/h, que entra a 50 ºC con una concentración del 96,0 %. El caudal de la corriente de aire atmosférico, expresado como aire seco, es 91.250 kg/h. A la salida de la torre de secado el ácido se refuerza con ácido sulfúrico de concentración 98,6 % a 70 ºC. Este ácido se bombea, en parte, al circuito de absorción (purga para mantener el nivel constante en el fondo de la torre de secado) y en su mayor parte se recicla a la parte alta de la torre, pasando antes a través de un refrigerante en el que se enfría desde la temperatura de bombeo hasta los 50 ºC, temperatura a la que entra en la torre. Determinar: a) la concentración y temperatura del ácido a la salida de la torre de secado; b) los caudales de ácido de refuerzo procedente del circuito de absorción y de purga del circuito de secado; c) la temperatura del ácido en la bomba (la misma que la del ácido a la entrada del refrigerante y del transferido al circuito de absorción), y d) la carga térmica del refrigerante de ácido. Solución: a). Humedad del aire (diagrama entálpico del aire húmedo (anexo B.5) 20 g/kg de aire seco Caudal de agua entrante en con el aire: 0,020 × 91.250 =1.825 kg/h Agua libre en el ácido entrante a la torre: 0,040 × 56.885 = 2.275,4 kg/h Balance de agua en la torre de secado: 1.825 + 2.275,4 = (1.825 + 56.885)(1-c1) Y c1 = 0,930 & 1 = 1.825 + 56.885 = 58.710 kg/h de ácido con una concentración del 93,0 % De la torre salen: m Balance entálpico en la torre (se supone que el aire sale a la misma temperatura del ácido en la parte alta de la torre): [kcal/h] Entran: Aire húmedo (diagrama anexo B.5)saturado a 25 ºC 18 × 91.250 = 1.642.500 Ácido del 96,0 % a 50 ºC (diagrama figura 5.4): -196 × 56.885 = - 11.149.460 Total - 9.506.960 Salen Aire seco a 50 ºC (diagrama anexo B.5) 12,4 × 91.250 = 1.131.500 Ácido diluido al 93,0 % a T1 (por diferencia) h1 × 58.710 = - 10.638.460 Resulta: h1 = -181,2 [kcal/kg] y del diagrama figura 5.4 se obtiene: T1 = 97 ºC 5.12 TECNOLOGÍA QUÍMICA INDUSTRIAL b) La mezcla del ácido de la torre y del ácido fuerte del circuito de absorción en la cuba debe resultar del 96,0 % concentración del ácido que la bomba enviará a la parte alta de la torre y al circuito de absorción. & a = 0,960(58.710 + m &a) m & a = 67.742 [kg/h] Balance de H2SO4: 0,930 × 58.710 + 0,986m El caudal enviado de secado a absorción (purga del circuito de secado) será la diferencia: &s = m &1 + m & a − 56.885 = 69.567 [kg/h] m Se comprueba que se verifica el balance de H2SO4 100% que entra y sale del circuito: 0,986 × 67.742. 0,960 × 69.567 . 66.789 [kg/h] y el balance de agua: 1.825 + (1-0,986)×67.742.(1-0,960)×69.567 .2.778 [kg/h] c). Balance entálpico en la cuba de circulación: [kcal/h] Entran: Ácido diluido al 93,0 % de fondo de la torrea 97 ºC: -181,2 × 58.710 = 10.638.460 Ácido del circuito de absorción del 98,6 % a 70 ºC: -182 × 67.442 = 12.274.444 Total 22.912.904 Sale: Ácido impulsado por la bomba del 96,0 % h2 ×126.152 = 22.912.904 Resulta: h2 = -181,6 [kcal/kg] y del diagrama figura 5.4 se obtiene: T2 = 90 ºC La misma temperatura tendrá el ácido débil transferido al circuito de absorción. d). El balance de entalpía alrededor del refrigerante de ácido proporciona la cantidad de calor eliminada por el agua de refrigeración: Q = (-196+181,6) × 56.885 = -819.144 [kcal/h] Ácidos sulfúrico y fosfórico. Fertilizantes 5.13 450 ºC Gases de cola BFW 440 ºC 590 º S CÁMARA DE COMBUSTIÓN DEAZUFRE 495 º 440 º 458 º Q´ 445 º 439 º AZUFRE FUNDIDO REACTOR s c 180 ºC 50 ºC 80 ºC ác. sulfúrico 98,6 % 50 ºC ác. sulf.98,6 % 70 ºC cw ác. sulf. 96,0 % Aire SECADO cw H 2O ABSORCIÓN Fig. 5. 8. Diagrama de proceso de fabricación de ácido sulfúrico a partir de azufre (simple absorción). La evolución del gas en el reactor adiabático puede representarse en el diagrama grado de conversión - temperatura que figura seguidamente: 5.14 TECNOLOGÍA QUÍMICA INDUSTRIAL Fig. 5. 9. Evolución de la conversión sobre el diagrama de equilibrio conversión-temperatura Ácidos sulfúrico y fosfórico. Fertilizantes 5.15 Ejercicio 7.3. Calcular la composición de los gases entrantes al reactor de la planta a que se refiere el ejercicio 7.2 que produce 1.000 Tm /día de ácido sulfúrico de concentración 98,6 %, con un caudal de aire seco de 96.563,6 kg/h y un rendimiento de azufre del 98,2 %. Calcular también el caudal y la composición de los gases que salen del tercer lecho catalítico (con una conversión acumulada del 96,0 %) y los de los gases de cola que salen por la chimenea a la atmósfera. Solución: Proceso de doble absorción - doble contacto Superar el 98,2 % de rendimiento de SO2 en la conversión es muy difícil, pero ello supone verter a la atmósfera el 1,8 % de la producción; es decir, ocasionar una contaminación importante. En la actualidad las legislaciones exigen valores de la emisión mucho más pequeños. Una mejora del rendimiento puede conseguirse introduciendo una absorción intermedia del SO3 producido en los primeros lechos con lo que el equilibrio de la reacción: SO2 + ½ O2 X SO3 se desplaza a la derecha, pues en la expresión de la constante de equilibrio: [SO3 ] = K [SO2 ][O2 ]1/2 para que el valor de la fracción permanezca constante, al disminuir el numerador, debe disminuir el denominador, a igualdad de presión y temperatura. Para efectuar la absorción intermedia se requiere enfriar los gases salientes del reactor y, después 5.16 TECNOLOGÍA QUÍMICA INDUSTRIAL de la absorción volver a calentarlos por encima de los 435 ºC para que el catalizador pueda actuar aumentando la velocidad de la reacción. Así se consiguen rendimientos de conversión superiores al 99,4 %. Un esquema simplificado del proceso de doble absorción-doble contacto es el de la figura 6.10. 450 ºC gases de cola BFW 438 ºC 590 ºC S 495 ºC CÁMARA DE COMBUSTIÓN DE AZUFRE Q 445 ºC 440 ºC 458 ºC 440 ºC AZUFRE FUNDIDO REACTOR s 180 ºC c 50 ºC 50 ºC Aire 70 ºC ác. sulfúrico 98,6 % 70 ºC cw H20 cw Ác. súlf 96,0 % 180 ºC 80 ºC cw ác. Sulfúrico cw 98,6 % Fig. 5. 10. Diagrama simplificado del proceso de fabricación de ácido sulfúrico a partir de azufre (doble contacto-doble absorción). Ácidos sulfúrico y fosfórico. Fertilizantes 5.17 Ejercicio 7.4. Determinar el rendimiento de la misma planta de los ejercicios anteriores, en la hipótesis de que se realice una absorción del SO3 a la salida del tercer lecho catalítico (tras la conversión del 96,0 %) y seguidamente se hacen pasar los gases por el cuarto lecho, del que salen a la misma presión y temperatura que en la variante de simple absorción. Calcular el caudal y la composición de los gases de cola que salen a la atmósfera. Solución: